题目内容
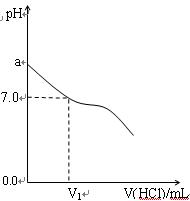
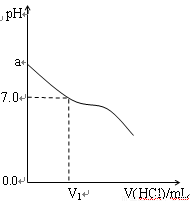
常温下,在20.0 mL 0.20 mol/L CH3COONa溶液中滴加0.20 mol/L的稀盐酸。溶液的pH的变化关系如下图所示。
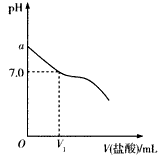
(1)a>7.0的理由是__________________(用离子方程式表示)。
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH刚好为7.0。此时溶液中c(Cl-)___c(CH3COOH)(填 “<”、“>”或“=”)。简要写出判断依据:_____________________。
(3)当加入盐酸的体积为20.0 mL时,测得溶液中的c(H+)为1.3×10-3 mol/L,则CH3COOH的电离平衡常数Ka=_______(计算结果保留两位有效数字)。
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH刚好为7.0。此时溶液中c(Cl-)___c(CH3COOH)(填 “<”、“>”或“=”)。简要写出判断依据:_____________________。
(3)当加入盐酸的体积为20.0 mL时,测得溶液中的c(H+)为1.3×10-3 mol/L,则CH3COOH的电离平衡常数Ka=_______(计算结果保留两位有效数字)。
(1)CH3COO-+H2O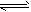 CH3COOH+OH-;
CH3COOH+OH-;
(2)=;根据电荷守恒有:c(OH-)+c(Cl-)+c(CH3COO-)=c(H+)+c(Na+),由于溶液的pH=7,c(OH-)=c(H+),所以c(Cl-) +c(CH3COO-)=c(Na+);而根据物料守恒有:c(CH3COOH)+c(CH3COO-)=c(Na+),所以有c(CH3COOH)=c(Cl- )
(3)1.7×10-5
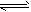 CH3COOH+OH-;
CH3COOH+OH-;(2)=;根据电荷守恒有:c(OH-)+c(Cl-)+c(CH3COO-)=c(H+)+c(Na+),由于溶液的pH=7,c(OH-)=c(H+),所以c(Cl-) +c(CH3COO-)=c(Na+);而根据物料守恒有:c(CH3COOH)+c(CH3COO-)=c(Na+),所以有c(CH3COOH)=c(Cl- )
(3)1.7×10-5

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目