题目内容
本题中所有的气体体积均为标准状况下的体积。A、B为两种单质,常温下均是固体。在元素周期表中A、B同周期且原子半径A>B。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验:
a.向第一份试样中加入过量的盐酸,充分反应后,放出0.896 L气体,还剩下0.56 g的残渣;
b.向第二份试样中加入过量的10%的NaOH溶液,充分反应后,放出0.896 L气体,还剩下0.96 g的残渣;
c.将第三份试样隔绝空气加强热后,生成一种固体,冷却后,再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质B是__________________。
(2)混合物中A的质量分数是__________________。
(3)写出实验c中有关反应的化学方程式并计算x的值。
a.向第一份试样中加入过量的盐酸,充分反应后,放出0.896 L气体,还剩下0.56 g的残渣;
b.向第二份试样中加入过量的10%的NaOH溶液,充分反应后,放出0.896 L气体,还剩下0.96 g的残渣;
c.将第三份试样隔绝空气加强热后,生成一种固体,冷却后,再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质B是__________________。
(2)混合物中A的质量分数是__________________。
(3)写出实验c中有关反应的化学方程式并计算x的值。
(1)Si (2)63.2%
(3)2Mg+Si Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑,x=0.448
Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑,x=0.448
(3)2Mg+Si
 Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑,x=0.448
Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑,x=0.448根据实验a可知,混合物中有一种单质可溶于盐酸且产生气体,即为金属单质,另一种单质不能溶于盐酸;根据实验b,中学阶段所学固体单质能与NaOH溶液反应产生气体的只有Si、Al,但实验a中还有残渣,故不可能为Al,这种单质只可能为Si,且为0.56 g,则另一单质的质量为0.96 g。根据实验a、b所得的数据,可求0.96 g单质的摩尔质量为: ="24" g·mol-1,即为Mg。根据原子半径A>B,可知A为Mg,B为Si。也可进行定性判断:因为A、B同周期,但金属单质不可能是Na,也不可能是Al,只能是Mg。
="24" g·mol-1,即为Mg。根据原子半径A>B,可知A为Mg,B为Si。也可进行定性判断:因为A、B同周期,但金属单质不可能是Na,也不可能是Al,只能是Mg。
(2)w(A)= ×100%=63.2%
×100%=63.2%
(3)根据题意,2Mg+Si Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑。并且0.96 g Mg与0.56 g Si刚好完全反应,则
Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑。并且0.96 g Mg与0.56 g Si刚好完全反应,则
Si — SiH4↑
28 g 22.4 L
0.56 g x L
x= =0.448。
=0.448。
 ="24" g·mol-1,即为Mg。根据原子半径A>B,可知A为Mg,B为Si。也可进行定性判断:因为A、B同周期,但金属单质不可能是Na,也不可能是Al,只能是Mg。
="24" g·mol-1,即为Mg。根据原子半径A>B,可知A为Mg,B为Si。也可进行定性判断:因为A、B同周期,但金属单质不可能是Na,也不可能是Al,只能是Mg。(2)w(A)=
 ×100%=63.2%
×100%=63.2%(3)根据题意,2Mg+Si
 Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑。并且0.96 g Mg与0.56 g Si刚好完全反应,则
Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑。并且0.96 g Mg与0.56 g Si刚好完全反应,则Si — SiH4↑
28 g 22.4 L
0.56 g x L
x=
 =0.448。
=0.448。
练习册系列答案
相关题目
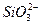 +H2O
+H2O