题目内容
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入28gN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).下列说法正确的是()
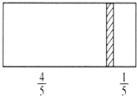
A. 右边CO和CO2的分子数之比为1:3
B. 右边CO的质量为2.75g
C. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,保持温度不变,则前后两次充入容器内的气体压强之比为5:3
D. 右侧气体密度是相同条件下氢气密度的16倍
【答案】D
【解析】
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分,当隔板稳定后,两边容器内的压强相同,在等温等压的条件下,气体的体积之比等于物质的量之比,左边28g氮气为1mol,则8gCO和CO2的混合气体为0.25mol,平均摩尔质量为32g/mol;
A. 根据十字交叉法,![]() 右边CO和CO2的分子数之比为3:1,A错误;
右边CO和CO2的分子数之比为3:1,A错误;
B. 右边CO的质量为28g/mol×0.25mol×1/4=1.75g,B错误;
C. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,保持温度不变,则第二次冲入气体的物质的量为0.2mol,同一密闭容器中,压强之比等于物质的量之比,前后两次充入容器内的物质的量之比为1.25:1.2,气体压强之比为25:24,C错误;
D. 同温同压下,相对密度之比等于摩尔质量之比,右侧气体密度是相同条件下氢气密度的16倍,D正确;
答案为D。

【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
B | 向酸性KMnO4 溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
C | 向溴水中加入苯,充分振荡、静 置 | 水层几乎无色 | 苯与溴发生了反应 |
D | 向FeCl3和BaCl2 的混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A.AB.BC.CD.D





