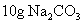题目内容
往8.4g的碳酸氢钠固体中逐滴加入稀盐酸,当不再产生气体时,消耗盐酸的体积为50.00ml,则该盐酸的物质的量浓度是多少。
析:
析:
NaHCO3+HCl=NaCl+H2O+CO2
1 1
8.4g/(84g/mol) 0.1mol
盐酸的浓度为0.1mol/0.050L=2.0mol/L.
1 1
8.4g/(84g/mol) 0.1mol
盐酸的浓度为0.1mol/0.050L=2.0mol/L.
NaHCO3+HCl=NaCl+H2O+CO2
1 1
8.4g/(84g/mol) 0.1mol
因此,盐酸的浓度为0.1mol/0.050L=2.0mol/L.
1 1
8.4g/(84g/mol) 0.1mol
因此,盐酸的浓度为0.1mol/0.050L=2.0mol/L.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 和
和
 和
和