题目内容
(2013?郑州一模)在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应平衡常熟与温度的关系如下表,则( )
|
分析:A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断;
B.相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数;
C.由表中数据可知,温度越高平衡常数越小,计算平衡常数,与80℃的平衡常数比较判断;
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,平衡向正反应进行,可以等效为增大压强,最终的平衡状态向正反应方向移动.
B.相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数;
C.由表中数据可知,温度越高平衡常数越小,计算平衡常数,与80℃的平衡常数比较判断;
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,平衡向正反应进行,可以等效为增大压强,最终的平衡状态向正反应方向移动.
解答:解:A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A错误;
B.25°C时反应Ni(s)+4CO(g)?Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25°C时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为=2×10-5,故B错误;
C.该温度下的平衡常数k=
=8,大于80℃的平衡常数,由表中数据可知,温度越高平衡常数越小,故小于80°C,故C错误;
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,平衡向正反应进行,可以等效为增大压强,最终的平衡状态向正反应方向移动,CO的体积分数减小,故D正确;
故选D.
B.25°C时反应Ni(s)+4CO(g)?Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25°C时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为=2×10-5,故B错误;
C.该温度下的平衡常数k=
| 0.5 |
| 0.54 |
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,平衡向正反应进行,可以等效为增大压强,最终的平衡状态向正反应方向移动,CO的体积分数减小,故D正确;
故选D.
点评:本题考查化学平衡常数及影响因素、化学平衡常数有关计算等,难度中等,注意掌握化学平衡常数的应用,D选项为易错点,注意根据等效平衡解答.

练习册系列答案
相关题目
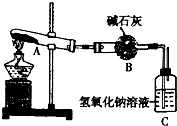 (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示.
(2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示.