题目内容
向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有气体产生.
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(2)产生的气体在标准状况下的体积是多少?
解:(1)14.51克白色沉淀是BaCO3和BaSO4混合物,加入过量的稀HNO3,充分反应后,剩余沉淀4.66g为BaSO4,BaSO4的物质的量为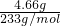 =0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为
=0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为 =0.4mol/L,
=0.4mol/L,
减少的沉淀质量为BaCO3,故BaCO3的质量为14.51g-4.66g=9.85g,物质的量为 =0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为
=0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为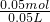 =1mol/L,
=1mol/L,
答:原混和溶液中Na2SO4和Na2CO3的物质的量浓度分别为0.4mol/L、1mol/L;
(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.05mol,故生成的二氧化碳的体积为0.05mol×22.4L/mol=1.12L,
答:产生的气体在标准状况下的体积为1.12L.
分析:(1)14.51克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与硝酸,BaCO3溶于硝酸,故白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g为BaSO4的质量,可得BaCO3的质量为14.51g-4.66g=9.85g,根据n= 计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c=
计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c= 计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.
点评:本题考查混合物的有关计算,难度不大,清楚反应过程理解沉淀质量减少的原因是关键.
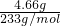 =0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为
=0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为 =0.4mol/L,
=0.4mol/L,减少的沉淀质量为BaCO3,故BaCO3的质量为14.51g-4.66g=9.85g,物质的量为
 =0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为
=0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为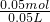 =1mol/L,
=1mol/L,答:原混和溶液中Na2SO4和Na2CO3的物质的量浓度分别为0.4mol/L、1mol/L;
(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.05mol,故生成的二氧化碳的体积为0.05mol×22.4L/mol=1.12L,
答:产生的气体在标准状况下的体积为1.12L.
分析:(1)14.51克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与硝酸,BaCO3溶于硝酸,故白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g为BaSO4的质量,可得BaCO3的质量为14.51g-4.66g=9.85g,根据n=
 计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c=
计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c= 计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.
点评:本题考查混合物的有关计算,难度不大,清楚反应过程理解沉淀质量减少的原因是关键.

练习册系列答案
相关题目