题目内容
2.下列离子组一定能大量共存的是( )| A. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 由水电离出c(H+)=10-3mol/L的溶液中:Na+、[Al(OH)4]-、NO3-、HCO3- | |
| C. | 无色溶液中可能大量共存在Fe3+、NH4+、Cl-、S2- | |
| D. | 1mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
分析 A.pH=12的溶液,显碱性;
B.由水电离出c(H+)=10-3mol/L的溶液,溶液显酸性;
C.Fe3+为黄色,且Fe3+、S2-发生氧化还原反应;
D.离子之间发生氧化还原反应.
解答 解:A.pH=12的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.由水电离出c(H+)=10-3mol/L的溶液,促进水的电离,溶液显酸性,不能大量存在[Al(OH)4]-、HCO3-,且[Al(OH)4]-促进HCO3-的电离,不能共存,故B错误;
C.Fe3+为黄色,与无色不符,且Fe3+、S2-发生氧化还原反应,不能共存,故C错误;
D.H+、Fe2+、NO3-发生氧化还原反应,不能共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息、常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
12.若用N原子替代异丁烷中的一个C原子,形成后的化合物的分子量为( )
| A. | 57 | B. | 58 | C. | 59 | D. | 60 |
13.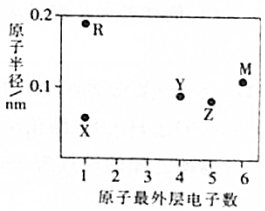 五种短周期主族元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如图所示,其中R的原子半径是短周期主族元素原子中最大的.下列说法正确的是( )
五种短周期主族元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如图所示,其中R的原子半径是短周期主族元素原子中最大的.下列说法正确的是( )
 五种短周期主族元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如图所示,其中R的原子半径是短周期主族元素原子中最大的.下列说法正确的是( )
五种短周期主族元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如图所示,其中R的原子半径是短周期主族元素原子中最大的.下列说法正确的是( )| A. | 元素的非金属性:X>Z>Y | |
| B. | M的单质常温常压下为气态 | |
| C. | X和M形成的二元化合物的水溶液呈弱酸性 | |
| D. | Y、Z、M的最高价氧化物的水化物均为强酸 |
12.分子式为C4H8Cl2的有机物共有(不含立体异构)( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
9. 容量分析中,可以根据溶液导电能力(单位:S/m)变化来确定滴定反应的终点.常温下,用0.l000mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.l000mol/L的HC1和CH3COOH溶液,其滴定曲线如图所示.下列判断不正确的是( )
容量分析中,可以根据溶液导电能力(单位:S/m)变化来确定滴定反应的终点.常温下,用0.l000mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.l000mol/L的HC1和CH3COOH溶液,其滴定曲线如图所示.下列判断不正确的是( )
 容量分析中,可以根据溶液导电能力(单位:S/m)变化来确定滴定反应的终点.常温下,用0.l000mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.l000mol/L的HC1和CH3COOH溶液,其滴定曲线如图所示.下列判断不正确的是( )
容量分析中,可以根据溶液导电能力(单位:S/m)变化来确定滴定反应的终点.常温下,用0.l000mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.l000mol/L的HC1和CH3COOH溶液,其滴定曲线如图所示.下列判断不正确的是( )| A. | A点前,①导电能力增加是因为弱电解质转化为强电解质 | |
| B. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})}$的值:A点<B点 | |
| C. | C点表示HC1溶液与NaOH溶液恰好完全反应 | |
| D. | A点的溶液中有:c(CH3COO-)+c(OH-)-c (H+)=0.05000mol/L |
10.下列化学式既能标明物质的组成,又能表示物质的一个分子的是( )
| A. | NH4Cl | B. | SiO2 | C. | NH3 | D. | Na2SO4 |
 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示, 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应: