题目内容
电力工业所需的钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:
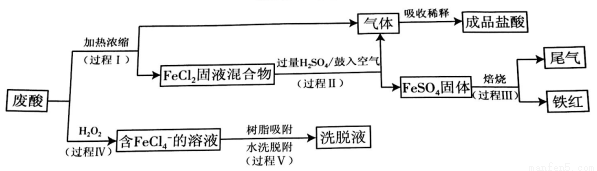
已知:i.酸洗钢制构件后得到废酸的主要成分如下表所示。

ii pH <4时,Fe2+不易被氧气氧化。
(1)酸洗钢制构件时发生反应的离子方程式:2H++ FeO=Fe2++H2O、_______________。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq)  FeSO4(s)+2HCl( aq)。
FeSO4(s)+2HCl( aq)。
①加入过量H2SO4的作用是_____________(至少写出两点)。
②用化学平衡原理解释鼓入空气的目的:_____________。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是_________________。
(4)过程IV发生反应的离子方程式是____________________。
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X-  RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-
RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-  Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液酸性下降的原因是_______________。
②洗脱液中主要含有的溶质是______________。
练习册系列答案
相关题目



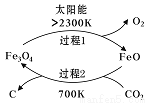
 2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。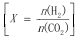 的关系如右图所示。
的关系如右图所示。

 ,下列说法正确的是
,下列说法正确的是