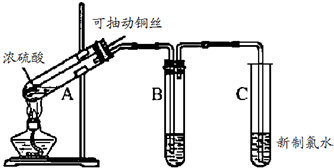
题目内容
某老师取6.4g铜丝和12mL18mol/L浓硫酸按教材中“铜与浓硫酸反应”的实验装置进行实验.
(1)试管A中反应的方程式是______.
(2)试管B用来探究SO2的漂白性,则应装的试剂是______.
(3)试管C中的实验现象为______.
(4)反应结束后将铜丝取出,洗净、烘干,称量剩余铜丝的质量3.2g.则试管中余酸的物质的量浓度约为______(假设溶液体积不变).
解:(1)铜和浓硫酸加热反应,浓硫酸具有强氧化性氧化铜为硫酸铜,本身被还原为二氧化硫,依据化学方程式的书写原则写出化学方程式:Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)探究SO2的漂白性需要用品红,二氧化硫通入品红会褪色;
故答案为:品红;
(3)二氧化硫通入氯水中发生反应Cl2+SO2+2H2O=H2SO4+2HCl,所以氯水中氯气的淡黄绿色逐渐褪去;
故答案为:淡黄绿色逐渐褪去;
(4)反应结束后将铜丝取出,洗净、烘干,称量剩余铜丝的质量3.2g,说明反应了铜的质量为6.4g-3.2g=3.2g,物质的量为0.05mol,发生反应的化学方程式为:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 消耗硫酸物质的量为0.1mol,所以剩余硫酸物质的量为0.216mol-0.1mol=0.116mol,剩余硫酸浓度=
CuSO4+SO2↑+2H2O 消耗硫酸物质的量为0.1mol,所以剩余硫酸物质的量为0.216mol-0.1mol=0.116mol,剩余硫酸浓度=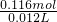 =9.7mol/L;
=9.7mol/L;
故答案为:9.7mol/L;
分析:6.4g铜丝和12mL18mol/L浓硫酸反应即0.1mol铜与0,216molH2SO4反应;
(1)铜与浓硫酸反应加热条件下生成硫酸铜、二氧化硫、水,依据氧化还原反应写出化学方程式;
(2)探究二氧化硫的漂白性所用试剂是品红;
(3)依据氯水的强氧化性能把二氧化硫氧化为硫酸分析;
(4)随着反应进行浓硫酸的浓度减小,变为稀硫酸时不再与铜反应;结合质量换算物质的量,运用化学方程式进行计算;
点评:本题考查了浓硫酸的化学性质,生成物二氧化硫的性质验证试验的试剂选择,化学方程式的计算.
 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O; (2)探究SO2的漂白性需要用品红,二氧化硫通入品红会褪色;
故答案为:品红;
(3)二氧化硫通入氯水中发生反应Cl2+SO2+2H2O=H2SO4+2HCl,所以氯水中氯气的淡黄绿色逐渐褪去;
故答案为:淡黄绿色逐渐褪去;
(4)反应结束后将铜丝取出,洗净、烘干,称量剩余铜丝的质量3.2g,说明反应了铜的质量为6.4g-3.2g=3.2g,物质的量为0.05mol,发生反应的化学方程式为:
Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O 消耗硫酸物质的量为0.1mol,所以剩余硫酸物质的量为0.216mol-0.1mol=0.116mol,剩余硫酸浓度=
CuSO4+SO2↑+2H2O 消耗硫酸物质的量为0.1mol,所以剩余硫酸物质的量为0.216mol-0.1mol=0.116mol,剩余硫酸浓度=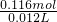 =9.7mol/L;
=9.7mol/L;故答案为:9.7mol/L;
分析:6.4g铜丝和12mL18mol/L浓硫酸反应即0.1mol铜与0,216molH2SO4反应;
(1)铜与浓硫酸反应加热条件下生成硫酸铜、二氧化硫、水,依据氧化还原反应写出化学方程式;
(2)探究二氧化硫的漂白性所用试剂是品红;
(3)依据氯水的强氧化性能把二氧化硫氧化为硫酸分析;
(4)随着反应进行浓硫酸的浓度减小,变为稀硫酸时不再与铜反应;结合质量换算物质的量,运用化学方程式进行计算;
点评:本题考查了浓硫酸的化学性质,生成物二氧化硫的性质验证试验的试剂选择,化学方程式的计算.

练习册系列答案
相关题目