题目内容
4. 已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )| A. | H2O的电子式为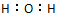 | B. | Z的沸点低于H2O的沸点 | ||
| C. | X+含有离子键 | D. | 含有Y-的溶液一定呈碱性 |
分析 X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,Z为NH3,结合图中转化可知X为NH4+,Y为OH-,以此来解答.
解答 解:A.O周围有8个电子,则H2O的电子式为 ,故A错误;
,故A错误;
B.H2O分子间含氢键比氨气分子间氢键多,沸点高,则Z的沸点低于H2O的沸点,故B正确;
C.X为NH4+,含N-H极性键,故C错误;
D.含有Y-的溶液不一定呈碱性,水溶液中均含OH-,故D错误;
故选B.
点评 本题考查无机物的推断,为高频考点,把握氨气的性质及图中转化、10电子微粒为解答的关键,侧重分析与推断能力的考查,注意Z为推断的突破口,题目难度不大.

练习册系列答案
相关题目
14.常温下,在C(OH-)=10-13mol•L-1的无色溶液中能大量共存,且加入NaOH溶液时会产生气体和沉淀的是( )
| A. | NH4+、NO3-、Mg2+、SO42- | B. | Na+、K+、NO3-、HCO3- | ||
| C. | K+、Cl-、Al(OH)4-、Fe3+ | D. | NH4+、Al3+、Cu2+、Cl- |
12.常温下的下列各种溶液中,可能大量共存的离子组是( )
| A. | pH=0的溶液中:Fe2+、NO3-、SO42-、I- | |
| B. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液中:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液中:Na+、I-、K+、NO3- | |
| D. | c(H+)=10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
19.下列物质不能使溴水褪色的是( )
| A. | CH2═CH2 | B. | SO2 | C. | CH2═CHCH2CH3 | D. | CH3CH2CH3 |
9.下列关于有机物的说法正确的是( )
| A. | 甲烷在光照下能与氯气发生取代反应,生成一系列甲烷氯代物和氯化氢 | |
| B. | 石油分馏和煤的干馏都是物理变化 | |
| C. | 乙烷、乙醇、乙酸都溶于水 | |
| D. | 甲烷、乙烯、乙炔和苯都不能使酸性 KMnO4 溶液褪色 |
16.下列有关甲烷的说法正确的是( )
| A. | 易溶于水 | B. | 是最简单的有机化合物 | ||
| C. | 与氯气发生加成反应 | D. | 与乙烷互为同分异构体 |
13.某同学按如图所示的装置做实验,下列说法不正确的是( )


| A. | 锌为负极,铜为正极 | B. | 电解质溶液的pH变大 | ||
| C. | 铜极上有气泡产生 | D. | 溶液中的阳离子向负极移动 |
16.下列离子方程式书写正确的是( )
| A. | 淀粉-KI试纸经硫酸酸化后在空气中变蓝:4I-+O2+2H2O═2I2+4OH- | |
| B. | Fe2O3溶于氢碘酸溶液:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═H2O+NH3↑ | |
| D. | 二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O═4H++2Br-+SO42- |
 氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在.某工厂处理氨氮废水的流程如下:
氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在.某工厂处理氨氮废水的流程如下: