题目内容
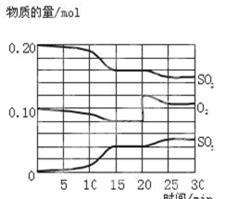
 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:(1)降低温度,SO2的转化率
增大
增大
,化学反应速度减小
减小
.(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是
15-20min和25-30min
15-20min和25-30min
.该反应的平衡常数表达式为:| c2(SO3) |
| c2(SO2)?c(O2) |
| c2(SO3) |
| c2(SO2)?c(O2) |
(3)反应进行至20min时,曲线发生变化的原因是
增大了氧气的浓度
增大了氧气的浓度
(用文字表达).10min到15min的曲线变化的原因可能是
ab
ab
(填写编号).a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量.
分析:(1)该反应正反应是放热反应,降低温度平衡向正反应移动,反应速率减小;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态;
平衡常数指达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.据此结合选项分析.
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态;
平衡常数指达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.据此结合选项分析.
解答:解:(1)该反应正反应为放热反应,降低温度平衡向正反应方向移动,二氧化硫转化率增大,降低温度反应速率减小,故答案为:增大;减小;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,
可逆反应2SO2(g)+O2 (g)?2SO3(g)的平衡常数k=
,
故答案为:15-20min和25-30min;
;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度,故答案为:增大了氧气的浓度;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误.
故选:ab.
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,
可逆反应2SO2(g)+O2 (g)?2SO3(g)的平衡常数k=
| c2(SO3) |
| c2(SO2)?c(O2) |
故答案为:15-20min和25-30min;
| c2(SO3) |
| c2(SO2)?c(O2) |
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度,故答案为:增大了氧气的浓度;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误.
故选:ab.
点评:本题考查平衡常数、平衡移动、平衡影响元素、化学平衡图象等,难度中等,图象问题解题步骤:(1)看懂图象:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图象中有关量的多少.(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
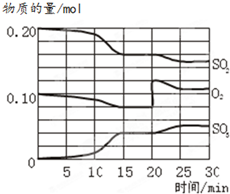 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 硫酸生产过程中关键阶段的反应为:
硫酸生产过程中关键阶段的反应为: 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示: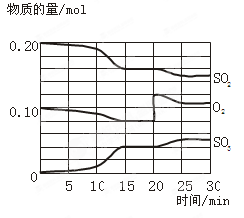
 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示: