题目内容
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定100mL浓度均为0.1mol·L-1 的三种酸(HM、HN和HR) 溶液,滴定的曲线如图所示,下列判断错误的是( )
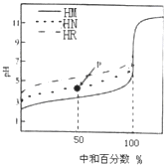
A. 三种酸的电离常数关系: KHR>KHN>KHM
B. pH=7时,三种溶液中:c (M-) >c (N-)>c (R-)
C. 滴定至P点时,溶液中:c (Na+) >c (N-) >c (HN) >c (H+) >c (OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR) =c(OH-)-c(H+)
【答案】AC
【解析】A项,三种酸(HM、HN和HR)溶液浓度均为0.1mol·L-1,酸的pH越大说明该酸的电离程度越小,则该酸的电离常数越小,由图可得,未加NaOH溶液时三种酸的pH大小顺序是HR>HN>HM,则三种酸的电离程度HR<HN<HM,所以三种酸的电离常数KHM>KHN>KHR,故A错误;B项,pH=7时,溶液呈中性,c(OH-)=c(H+),根据电荷守恒,三种酸溶液中分别存在c(M-)=c(Na+)、c(N-)=c(Na+)、c(R-)=c(Na+),相同浓度、相同体积的三种酸溶液与NaOH中和至中性时,酸的电离程度越大消耗NaOH的体积越大,则混合溶液中钠离子浓度越大,因为三种酸的电离常数KHM>KHN>KHR,则三种酸消耗NaOH的体积:HM>HN>HR,所以三种溶液中c(M-)>c(N-)>c(R-),故B正确;C项,由图可知,P点溶液呈酸性,c(H+)>c(OH-),溶液为等物质的量浓度的NaN和HN的混合溶液,因为溶液呈酸性,说明HN的电离程度大于N-水解程度,结合物料守恒可知,溶液中:c(N-)>c(Na+)>c(HN)>c(H+)>c(OH-),故C错误;D项,因为三种酸的初始浓度和体积均相同,所以当中和百分数达100%时,将三种溶液混合后,根据质子守恒得:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+),故D正确。

【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |


