题目内容
11.从防止污染、减少用酸量之可持续发展的角度分析,下列利用金属铜制取Cu(NO3)2的方法中最好的是( )| A. | Cu$\stackrel{浓HNO_{3}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀HNO_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{Ot}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
分析 从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染;
A.铜与浓硝酸制取硝酸铜时生成的NO2会造成大气污染,不环保;
B.铜与稀硝酸制取硝酸铜时生成的NO也会造成大气污染,不环保;
C.铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜和水,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料;
D.铜和浓硫酸反应需要加热消耗能量高,且反应过程中生成的二氧化硫有毒,有污染;
解答 解:假设都制取1mol硝酸铜.
A.铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,不环保,制取1mol硝酸铜需消耗1mol铜、4mol硝酸;
B.铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,不环保,制取1mol硝酸铜需消耗1mol铜、$\frac{8}{3}$mol硝酸;
C.此过程用方程式可表示为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,制取1mol硝酸铜需消耗1mol铜、2mol硝酸,环保且没有多消耗原料;
D.铜和浓硫酸反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2,需要加热消耗能量高,且反应过程中生成的二氧化硫有毒,有污染,制取1mol硝酸铜需消耗1mol铜、1mol硝酸钡,生成1mol硫酸钡;
制取相同物质的量的Cu(NO3)2,A、B、C方案中C所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体,C、D方案中C原料的利用率最高,且不产生污染环境的气体;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备实验及节约原料和防止环境污染,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度中等.

| A. | 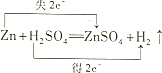 | B. |  | ||
| C. | 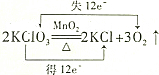 | D. |  |
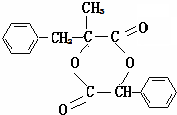
 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaI B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如下表:
| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
 .
. .
. .
. (写结构简式).
(写结构简式).

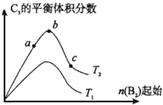 已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ. 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示:
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示: