题目内容
H2O2是一种重要的氧化剂,亦具有还原性.下列①~④个涉及H2O2的反应(未配平、条件略).①Na2O2+HCl→NaCl+H2O2
②H2O2→H2O+O2
③Ag2O+H2O2→Ag+O2+H2O
④H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O.
据此,填写下列空白:
(1)配平上述反应④
[
当0.1mol氧化剂参加反应时,转移电子
(2)H2O2仅体现还原性的反应是
(3)H2O2体现弱酸性的反应是
分析:(1)根据氧化还原反应中得失电子数相等配平方程式进行解答;
(2)根据还原剂体现还原性以及还原剂化合价升高进行解答;
(3)根据盐酸和过氧化钠反应生成过氧化氢,利用强酸制弱酸的原理进行解答.
(2)根据还原剂体现还原性以及还原剂化合价升高进行解答;
(3)根据盐酸和过氧化钠反应生成过氧化氢,利用强酸制弱酸的原理进行解答.
解答:解:(1)一个双氧水分子参加氧化还原反应时得2个电子,一个铬离子参加氧化还原反应失去3个电子,所以得失电子的最小公倍数是6,则双氧水的计量数是3,铬离子的计量数是1,然后根据原子守恒配平其它原子,所以该反应是系数是3,1,10,2,3,8,当0.1mol氧化剂参加反应时,转移电子0.2mol,即为1.204×1023个,
故答案为:3,1,10,2,3,8;1.204×1023;
(2)H2O2仅体现还原性,则氧元素的化合价只升高不降低,反应③符合,对应的氧化产物是氧气,
故答案为:③;O2;
(3)反应Na2O2+HCl→NaCl+H2O2中,由其盐与强酸盐酸反应值制得,其中H2O2体现了弱酸性,
故答案为:①;此反应中由其盐与强酸盐酸反应值制得.
故答案为:3,1,10,2,3,8;1.204×1023;
(2)H2O2仅体现还原性,则氧元素的化合价只升高不降低,反应③符合,对应的氧化产物是氧气,
故答案为:③;O2;
(3)反应Na2O2+HCl→NaCl+H2O2中,由其盐与强酸盐酸反应值制得,其中H2O2体现了弱酸性,
故答案为:①;此反应中由其盐与强酸盐酸反应值制得.
点评:本题是一道有关氧化还原反应知识的综合型题目,注意元素化合价的判断,题目较为综合,难度中等,思维含量大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
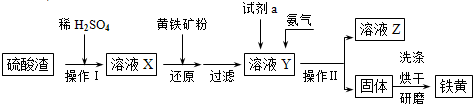
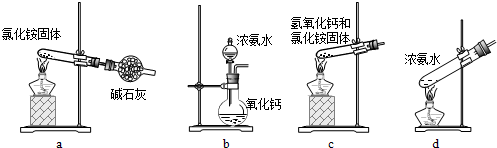
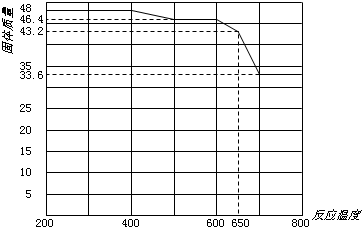
 1)配平上述反应④,并标出电子转移方向与数目。
1)配平上述反应④,并标出电子转移方向与数目。