题目内容
证明氟化氢是弱电解质的事实是( )
| A.氟化氢在所有卤化氢中热稳定性最强 |
| B.浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 |
| C.100 mL 0.1 mol/L氢氟酸中c(H+)小于0.1 mol/L |
| D.测得常温下0.1 mol/L NaF溶液的pH>7 |
CD
解析

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
已知常温下BaSO4的溶解度为2.33×10-4g,类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=〔C(An+)〕m·〔C(Bm-)〕n,,则BaSO4的Ksp约为
| A.2.33×10-4 | B.1×10-5 | C.1×10-10 | D.1×10-12 |
关于常温下pH=2的醋酸溶液,下列叙述正确的是
| A.c(CH3COOH)=0.01mol·L-1 |
| B.c(H+)=c(CH3COO-) |
| C.加水稀释100倍后,溶液pH=4 |
| D.醋酸的电离常数为Ka,CH3COO-的水解常数为Kh,则Ka·Kh=Kw |
下列有关说法正确的是
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )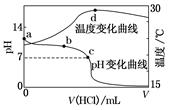
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
下列四种溶液中,水的电离程度最大的是( )
| A.pH=5的NH4Cl溶液 |
| B.pH=5的NaHSO4溶液 |
| C.pH=8的CH3COONa溶液 |
| D.pH=8的NaOH溶液 |
人体血液里存在如下平衡:CO2+H2O H2CO3
H2CO3
 使人体内血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH随c(
使人体内血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH随c( ):c(H2CO3)变化关系如表所示,则下列说法中,正确的是
):c(H2CO3)变化关系如表所示,则下列说法中,正确的是
c( ):c(H2CO3) ):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.正常人体血液中,
 的水解程度小于电离程度
的水解程度小于电离程度B.人体发生酸中毒时,可饮用碳酸饮料缓解
C.pH=7.00的血液中,c(H2CO3)=c(
 )
)D.常温下将pH=7.40的血液稀释至pH=7.35,c(H+)·c(OH-)一定不变
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ<HY< HX |
| B.在HZ中加入NaOH至恰好完全反应时,溶液中各离子浓度大小顺序: c(Na+)>c(Z-)>c(OH—)>c(H+) |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)+c(Y—)+c(OH—)= c(Na+)+c(H+) |
| D.将HX和HZ溶液混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)= c(X—)+ c(Z—) |