题目内容
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是
| A.1:2混合的PbO2、Pb3O4 |
| B.1:1混合的Pb3O4、PbO |
| C.1:2:4混合的PbO2、Pb3O4、PbO |
| D.1:4:1混合的PbO2、Pb3O4、PbO |
B
解析试题分析:PbO2受热分解得到氧气和铅的氧化物的混合物(Pb为+4、+2价),铅的氧化物的混合物再与盐酸作用时,+4价Pb还原为+2价,Cl-被氧化为Cl2,此时得到溶液为PbCl2溶液,利用“电子转移守恒”知1molPbO2在上述转化过程中共转移电子为1mol×(4-2)=2mol,设该过程得到O2的物质的量为3xmol,则Cl2的物质的量为2xmol,利用电子转移守恒有:3x×4+2x×2=2,解得x=0.125,故知1mol PbO2在受热分解过程中产生O2为0.125mol×3=0.375mol,利用原子守恒可知受热后的剩余固体中n(O)=2mol-0.375mol×2=1.25mol,故属于固体中n(Pb):n(O)=1mol:1.25mol=4:5。A、1:2混合的PbO2、Pb3O4,n(Pb):n(O)=(1+6):(2+8)=7:10,错误;B、1:1混合的Pb3O4、PbO,n(Pb):n(O)=(3+1):(4+1)=4:5,正确;C、1:2:4混合的PbO2、Pb3O4、PbO,n(Pb):n(O)=(1+2×3+4):(2+2×4+4)=11:14,错误;D、1:4:1混合的PbO2、Pb3O4、PbO,n(Pb):n(O)=(1+12+1):(2+16+1)=14:19,错误。
考点:本题考查氧化还原反应的计算、化学式的推断。

 名校课堂系列答案
名校课堂系列答案下列变化需要加入适当的氧化剂才能完成的是 ( )
| A.CuO→Cu | B.HNO3→NO |
| C.Na2SO3→SO2 | D.FeCl2→FeCl3 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O =4NaOH+O2↑ | B.Cl2 + H2O  HClO + HCl HClO + HCl |
| C.2F2+2H2O=4HF+O2 | D.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72->Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1molK2Cr2O7参加反应,转移电子的数目为6NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7 |
已知Cu+在酸性条件下能发生下列反应:Cu+ Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中铜元素全部被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
用高铁酸钠(Na2FeO4)对河(湖)水消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是( )
2Na2FeO4+Na2O,下列说法正确的是( )
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |
有如下变化:A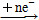 An- ΔH1<0,B
An- ΔH1<0,B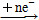 Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
| A.氧化性:A<B | B.还原性:An-<Bn- |
| C.稳定性:B<A | D.稳定性:An-<Bn- |
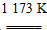 aTiCl4+cCO
aTiCl4+cCO Ti+2MgCl2
Ti+2MgCl2 mol
mol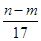 mol
mol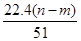 L
L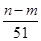 +
+