题目内容
【题目】某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe3+、Fe2+、CO32-、SO32-、Cl-、SO42-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容如下:
①用洁净的玻璃棒蘸取少量X溶液,点在PH 试纸上,试纸呈红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B,在瓶口又慢慢变为红棕色
③向溶液A 中加入过量的NaOH 溶液,微热,放出一种刺激性气味的气体C,同时产生红褐色沉淀D,过滤得溶液F;
④向F溶液中通入过量的CO2,有白色沉淀G生成。请回答:
(1)G的化学式为:___________________________。
(2)检验气体C的方法_____________________;
(3)步骤②中反应的离子方程式为:_________________________;
(4)步骤3③中反应的离子方程式为:_______________________________;
(5)X溶液中一定含有的离子是_______________________________;在不能确定是否含有的离子中,若要确定其中一种,补做的实验是_________________________。
【答案】 A1(OH)3 用湿润的红色石蕊试纸,若变蓝则为氨气 4H++3Fe2++NO3-=3Fe3++ NO↑+2H2O A13++4OH-= A1O2-+2H2O Fe3++3OH-= Fe(OH)3↓ NH4++OH-![]() NH3↑+H2O H+、Al3+、NH4+、Fe2+、Cl- 取少量X溶液于试管中,加入几滴KSCN。溶液变红色说明有Fe3+,否则无Fe3+或者取少量X溶液于试管中,加人几滴稀硫酸,如出现白色沉淀,则说明有Ba2+,否则无Ba2+。
NH3↑+H2O H+、Al3+、NH4+、Fe2+、Cl- 取少量X溶液于试管中,加入几滴KSCN。溶液变红色说明有Fe3+,否则无Fe3+或者取少量X溶液于试管中,加人几滴稀硫酸,如出现白色沉淀,则说明有Ba2+,否则无Ba2+。
【解析】在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,得澄清透明的溶液A,说明溶液中不存在SO42-,实验中还放出一种无色无味的气体B,在瓶口又慢慢变为红棕色,说明硝酸根离子在酸性环境中被还原为一氧化氮,一氧化氮在空气中被氧化为红棕色的二氧化氮,则溶液中存在还原性的Fe2+;向溶液A 中加入过量的NaOH 溶液,微热,放出一种刺激性气味的气体C,同时产生红褐色沉淀D,过滤得溶液F;C为氨气,D为Fe(OH)3,说明原溶液中存在NH4+,但不一定存在Fe3+;由于原溶液中存在H+、Fe2+,则肯定没有NO3-,根据溶液中电荷守恒,必须存在阴离子,所以,肯定存在Cl-。向F溶液中通入过量的CO2,有白色沉淀G生成,则G为A1(OH)3,说明原溶液中存在铝离子。
(1)G G为A1(OH)3;
(2)检验气体氨气的方法是用湿润的红色石蕊试纸,若变蓝则为氨气;
(3)步骤②中亚铁离子被硝酸氧化,其反应的离子方程式为: 4H++3Fe2++NO3-=3Fe3++ NO↑+2H2O;
(4)步骤3③中反应的有三个,Al3+、NH4+、Fe3+与足量的碱反应,离子方程式为: A13++4OH-= A1O2-+2H2O、Fe3++3OH-= Fe(OH)3↓、NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(5)经上述分析X溶液中一定含有的离子有:H+、Al3+、NH4+、Fe2+、Cl-;不能确定Ba2+、Fe3+是否存在;若要证明Ba2 +的存在,取少量X溶液于试管中,加人几滴稀硫酸,如出现白色沉淀,则说明有Ba2+,否则无Ba2+。若要证明Fe3 +的存在,取少量X溶液于试管中,加入几滴KSCN,溶液变红色说明有Fe3+,否则无Fe3+。

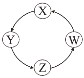
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④