题目内容
【题目】Sn(核电荷数为50)是人类最早使用的元素之一,能形成SnCl2 , SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度. 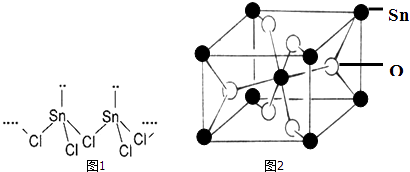
(1)Sn元素外围电子排布式为 .
(2)SnCl2的一维链状聚合结构如图1所示,在分子结构中存在的化学键是 .
(3)SnCl4与CCl4中沸点较高的是 . 原因是 .
(4)锡的某种氧化物的晶胞如图2,其化学式为 .
(5)解释白锡分子的密度大于灰锡的密度的原因 .
【答案】
(1)5s25p2
(2)共价键、配位键
(3)SnCl4 ;SnCl4相对分子质量大,范德华力大
(4)SnO2
(5)配位数大,空间利用率大
【解析】解:(1)Sn属于ⅣA族元素,价电子排布式为ns2np2 , 位于第5周期,可确定其价电子排布式为:5s25p2 , 所以答案是:5s25p2;(2)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的Cl,其中一条为配位键,配位键表示为由形成两条共价键的Cl指向Sn;
所以答案是:共价键、配位键;(3)SnCl4与CCl4都属于分子晶体,所以相对分子质量较大的分子,范德华力大,熔沸点较高,
所以答案是:SnCl4;SnCl4相对分子质量大,范德华力大;(4)O位于体心和面心,数目为2+4× ![]() =4,Sn位于顶点和体心,数目为8×
=4,Sn位于顶点和体心,数目为8× ![]() +1=2,原子数目比为2:1,化学式为SnO2;
+1=2,原子数目比为2:1,化学式为SnO2;
所以答案是:SnO2;(5)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数为4,前者配位数较大,其空间利用率较大,所以其密度大于灰锡,
所以答案是:配位数大,空间利用率大.

 备战中考寒假系列答案
备战中考寒假系列答案【题目】西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害.已知其相关性质如表所示:
分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
C12H10ClN3O |
| 白色结晶粉末 | 170~172°C | 易溶于水 |
(1)氯元素基态原子核外电子的成对电子数为 , 氯吡苯脲中所含元素能形成10电子分子,且分子之间能形成氢键的有 . (填二种,填化学式)
(2)氯吡苯脲的晶体类型为晶体.该分子是由键形成的分子(填“极性”或“非极性”)