题目内容
【题目】用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( ) 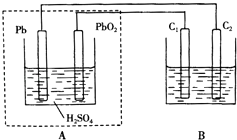
A.铅蓄电池工作一段时间后A溶液的pH变小
B.当B烧杯中I﹣的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol
C.当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过
D.铅蓄电池工作时负极电极反应式为:PbO2﹣2e﹣+H2SO4═PbSO4+2H2O+SO ![]()
【答案】B
【解析】解:A、铅蓄电池工作时反应:PbO2+2H2SO4+Pb═2PbSO4+2H2O,氢离子浓度减小,所以溶液的PH增大,故A错误;B、当B烧杯中I﹣的浓度降为0.05mol/L时消耗的物质的量=0.05×0.1=0.005mol,转移电子0.005mol,2H2O+SO2﹣2e﹣=SO ![]() +4H+ , 转移电子=0.1×0.1×2=0.02mol,共转移0.025mol,据PbO2+2H2SO4+Pb═2PbSO4+2H2O得知转移2mol的电子消耗2mol的硫酸,所以消耗硫酸0.025mol,故B正确;
+4H+ , 转移电子=0.1×0.1×2=0.02mol,共转移0.025mol,据PbO2+2H2SO4+Pb═2PbSO4+2H2O得知转移2mol的电子消耗2mol的硫酸,所以消耗硫酸0.025mol,故B正确;
C、当C1、C2两极均开始产生气体时,碘离子放电完全,根据碘离子的物质的量计算通过的电子个数,碘离子的物质的量=0.1mol/L×0.1L=0.01mol,
2I﹣﹣2e﹣=I2
2mol 2NA
0.01mol 0.01NA
所以至少已有6.02×1021个电子从电路中流过,故C错误;
D、铅蓄电池放电时,负极上铅失去电子和硫酸根离子反应生成硫酸铅,电极反应式为 Pb+SO42﹣﹣2e﹣=PbSO4 , 故D错误;
故选B.

【题目】在25’C时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
平衡浓度/mol/L | 0. 05 | 0. 05 | 0.1 |
下列说法错误的是
A. 反应达衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数