题目内容
工业上利用软锰矿(主要成分为MnO2)用来制备“锰白”(MnCO3)和电极材料锰酸锂(LiO2·2MnO2·Mn2O3),期其工艺流程如下:
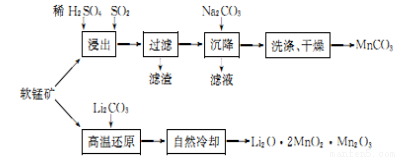
(1)“浸出”过程中SO2作用是__________。
(2)为使原料充分利用,滤液中c(Mn2+)应当小于__________mol·L-1。已知:常温下MnCO3的Kap=9.0×10-12。
(3)写出软锰矿与Li2CO3发生“高温还原”的化学方程式:____________。
(4)锰酸锂((LiO2·2MnO2·Mn2O3,M=362g· mol-1)中掺入LiMnO2能大幅提高电容量,实验室测定某电极材料中两者配比的操作步骤如下;准确称取2.012g的试样于锥形瓶中,加入5mL稀硫酸充分溶解;向上述所得溶液中加入10.00mL2.000mol·L-1草酸钠(Na2C2O4)标准溶液,搅拌至溶液清亮,并定容至250mL;从容量瓶中取出25.00mL溶液,用0.01mol·L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液20.00mL。通过计算两者物质的量之比_____(写出计算过程)。
已知实验中设计的相关氧化还原反应如下:
①Mn2++C2O42-→Mn2++2CO2↑
②Mn4++C2O42-→Mn2++2CO2↑
③MnO4-+C2O42-+H+→Mn2++2CO2↑(均未配平)
已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:

①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3 min~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)反应中浓硫酸的作用是______________________________________;
写出制取乙酸乙酯的化学方程式:_____________________________。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是___________________;
步骤③所观察到的现象是_____________________________________;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________(填“下口放”或“上口倒”)出。
在一定条件下,X既能与Y反应又能与Z反应,且都属于复分解反应的是
选项 | X | Y | Z |
A | Cu | HNO3 | Fe(NO3)3 |
B | FeCl3 | Zn | NaHCO3 |
C | O2 | NH3 | SO2 |
D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
A. A B. B C. C D. D


 Ca B. 氮分子的电子式::N:::N:
Ca B. 氮分子的电子式::N:::N: D. 聚乙炔的结构简式:
D. 聚乙炔的结构简式: