题目内容
在含有1.0 mol?L-1 的 Fe3+ 和 1.0 mol?L-1的Fe2+的溶液中加入KCN(s)有[Fe(CN)6]3-,[Fe(CN)6]4- 配离子生成。当系统中c (CN-) =1.0 mol?L-1 ,c ([ Fe (CN)6]3- = c ([ Fe (CN)6]4- = 1.0 mol?L-1时,计算E(Fe3+/ Fe2+)。
向Fe3+(aq) + e-![]() Fe2+(aq)中加KCN后,发生下列配合反应:
Fe2+(aq)中加KCN后,发生下列配合反应:
Fe3+(aq) + 6CN-(aq) ![]() [Fe(CN)6]3-(aq)
[Fe(CN)6]3-(aq) ![]()
Fe2+(aq) + 6CN-(aq) ![]() [Fe(CN)6]4-(aq)
[Fe(CN)6]4-(aq) ![]()
![]() =
=![]()
![]()
当 c (CN-) = c ([ Fe (CN)6]3- = c ([ Fe (CN)6]4-= 1.0 mol?L-1时
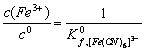 ;
;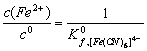
所以,![]() =
=![]()
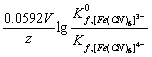
= 0.769 V ![]() = 0.36 V
= 0.36 V

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目