题目内容
【题目】(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2 △H <0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2 △H <0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________。
②假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_________。
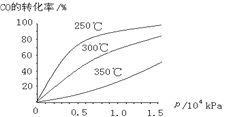
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。
【答案】 1.88×10-4 mol/(L·s) C、D -41.8 b 8/3 <
【解析】(1)本题考查化学反应速率的计算、勒夏特列原理,①前2s消耗NO的浓度为(10×10-4-2.5×10-4)mol·L-1=7.5×10-4mol·L-1,生成N2的浓度为7.5×10-4/2mol·L-1=3.75×10-4mol·L-1,根据化学反应速率数学表达式,v(N2)=3.75×10-4/2mol/(L·s)≈1.88×10-4 mol/(L·s);②A、催化剂只加快反应速率,对化学平衡的移动无影响,故A错误;B、此反应的正反应是放热反应,升高温度,平衡向逆反应方向进行,NO的转化率降低,故B错误;C、此反应的正反应是放热反应,降低体系温度,平衡向正反应方向进行,NO的转化率提高,故C正确;D、缩小容器的体积,相当增大压强,平衡向正反应方向移动,NO的转化率增大,故D正确;(2)考查盖斯定律的应用和化学平衡状态的判断,①2SO2(g)+O2(g)![]() 2SO3(g),②2NO(g)+O2(g)
2SO3(g),②2NO(g)+O2(g)![]() 2NO2(g),根据目标反应方程式,(①-②)/2,得出△H=(-196.6+113.0)/2kJ·mol-1=-41.8kJ·mol-1;a、根据反应方程式,推出反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故a错误;b、NO2为红棕色气体,其余均为无色气体,因此当气体颜色不再改变,说明反应达到平衡,故b正确;c、根据反应方程式,生成SO3和NO的物质的量相等,即任何时刻,SO3和NO物质的量都相等,因此SO3和NO的体积比保持不变,不能说明反应达到平衡,故c错误;d、生成NO2和消耗SO3,反应都是向逆反应方向进行,不能说明反应达到平衡,故d错误;令NO2的物质的量为1mol,SO2的物质的量为2mol,
2NO2(g),根据目标反应方程式,(①-②)/2,得出△H=(-196.6+113.0)/2kJ·mol-1=-41.8kJ·mol-1;a、根据反应方程式,推出反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故a错误;b、NO2为红棕色气体,其余均为无色气体,因此当气体颜色不再改变,说明反应达到平衡,故b正确;c、根据反应方程式,生成SO3和NO的物质的量相等,即任何时刻,SO3和NO物质的量都相等,因此SO3和NO的体积比保持不变,不能说明反应达到平衡,故c错误;d、生成NO2和消耗SO3,反应都是向逆反应方向进行,不能说明反应达到平衡,故d错误;令NO2的物质的量为1mol,SO2的物质的量为2mol,
NO2(g)+SO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
起始: 1 2 0 0
变化: x x x x
平衡: 1-x 2-x x x,根据信息,测的上述反应平衡时NO2和SO2的体积比为1:6,相同条件下,体积比等于物质的量之比,即(1-x):(2-x) =1:6,解得x=4/5,平衡常数K=  ,代入数值,解得K=8/3;(3)考查勒夏特列原理,等压下,温度越高,CO的转化率降低,根据勒夏特列原理,升高温度,平衡向逆反应方向移动,即△H<0。
,代入数值,解得K=8/3;(3)考查勒夏特列原理,等压下,温度越高,CO的转化率降低,根据勒夏特列原理,升高温度,平衡向逆反应方向移动,即△H<0。