题目内容
【题目】(1)①根据图1所示,写出反应的热化学方程式______________________________。
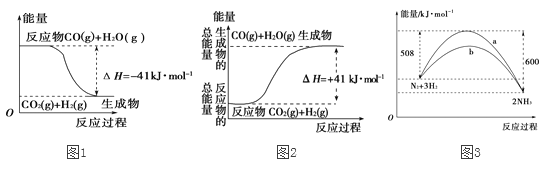
②根据图2所示情况,判断下列说法中正确的是 (____)
A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是___________________。
(3)图3是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:______________________________。a、b两条曲线分别代表生成由N2、H2合成氨的两个不同反应过程,其反应热△Ha ___△Hb(填“>”或“<”或“=”)。
【答案】 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 BD S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1 N2(g)+3H2(g) ===2NH3(g) ΔH=-92 kJ·mol-1 =
【解析】(1)图象分析可知为放热反应,反应的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;
②图象分析生成物能量高于反应物可知为吸热反应,则根据图象该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol;A.将反应的反应物与生成物弄反了,故A错误;;B.生成物的能量比反应物的能量高,故该反应为吸热反应,故B正确;C.生成物的能量比反应物的能量高,故该反应为吸热反应,故C错误;D.因为气态水变成液态水还要放热,当H2O为液态时,其反应热值小于41kJ/mol,故D正确;故选BD;
(2)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g)△H=-296.8kJ/mol;
(3)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92kJmol-1 ;使用催化剂,可以改变反应活化能,但不改为反应热效应,故△Ha=△Hb。