题目内容
20.某研究性学习小组为测定某铝镁合金(不含其他元素)中镁的质量分数,选取1mol/L的NaOH溶液与稀硫酸溶液,分别设计了下列两种不同实验方案进行探究,请根据他们的设计回答有关问题.已知:
①Mg+2H+═Mg2++H2;但Mg不与NaOH溶液反应
②2Al+6H+═2Al3++3H2
③2Al+2NaOH+2H2O═2NaAlO2+3H2
④
[探究一]实验方案:称量x g铝镁合金粉末,放入足量的1mol/L的NaOH溶液中使其充分反应后过滤.
(1)欲计算Mg的质量分数,该实验中还需测定的数据是镁的质量;
(2)该方案所涉及的化学反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑(用离子方程式表式).
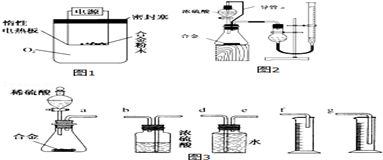
[探究二]实验方案:选取如图所示所需装置,称量x g铝镁合金粉末溶于足量的稀硫酸,测定生成气体的体积为VL(已转化为标准状况).
(3)同学们拟选用如图2的实验装置完成实验,你认为最简易的装置的连接顺序是a接e,d接g,.接..(填接口字母,空格不一定填完,不够可加);
(4)据此操作测定铝镁合金中镁的质量分数为$\frac{806.4x-648V}{201.6x}$×100%(用含x、V的式子表示).
分析 探究一实验原理为:镁铝合金和氢氧化钠溶液反应,铝溶解生成偏铝酸钠和氢气,反应后过滤得镁的质量,进而求得铝的质量,据此计算和分析;
探究二实验原理为:利用铝镁合金粉末与足量的盐酸反应,测定产生氢气的体积,根据铝镁合金粉末的质量与产生氢氧的总体积列方程组可求得镁、铝的各自的质量,根据实验原理可知,装置的组装顺序:合金与稀硫酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,据此答题.
解答 解:探究一实验原理为:镁铝合金和氢氧化钠溶液反应,铝溶解生成偏铝酸钠和氢气,反应后过滤得镁的质量,进而求得铝的质量,
(1)欲计算Mg的质量分数,该实验中还需测定的数据是过滤后得到的镁的质量,
故答案为:镁的质量;
(2)该方案所涉及的化学反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
探究二实验原理为:利用铝镁合金粉末与足量的盐酸反应,测定产生氢气的体积,根据铝镁合金粉末的质量与产生氢氧的总体积列方程组可求得镁、铝的各自的质量,(3)根据实验原理可知,装置的组装顺序:合金与稀硫酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,所以最简易的装置的连接顺序是a接e,d接g,
故答案为:e,d接g;
(4)实验后测得生成的氢气在标准状况下为VL,物质的量=$\frac{V}{22.4}$mol,设合金中Mg物质的量为x,Al物质的量的为y
$\left\{\begin{array}{l}{x+1.5y=\frac{V}{22.4}}\\{24x+27y=xg}\end{array}\right.$
解得x=$\frac{33.6x-27V}{201.6}$mol,
所以镁的质量分数=$\frac{\frac{33.6x-27V}{201.6}×24}{x}$×100%=$\frac{806.4x-648V}{201.6x}$×100%,
故答案为:$\frac{806.4x-648V}{201.6x}$×100%.
点评 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

| A. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| B. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| C. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 | |
| D. | 某个多电子原子的3p能级上仅有两个电子,它们必然自旋状态不同 |
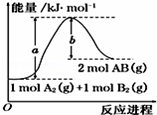
| A. | 断裂1mol A-A和1mol B-B键,放出a kJ能量 | |
| B. | 每生成2mol AB(g)吸收b kJ | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 该反应热△H=+(a-b) kJ•mol-1 |
| A. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4L H2O含有的分子数为NA | |
| C. | 46 g金属钠在氯气中充分燃烧生成NaCl,反应中转移电子数为2NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
| A. | 每生成1mol O2,该反应转移电子的物质的量是9mol | |
| B. | 该反应中Cl2既是氧化剂,又是还原剂 | |
| C. | □上的物质是AgCl | |
| D. | 参加反应的Cl2有$\frac{4}{9}$被水还原 |
| A. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| B. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4kJ•mol-1 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2[ | |
| D. | 已知2H2(g)+O2(g)=2H2O(l);△H=-571.6 kJ•mol-1,则氢气的燃烧热为285.8 kJ•mol-1 |
