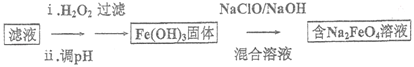
题目内容
【题目】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是___________(填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为______________________。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
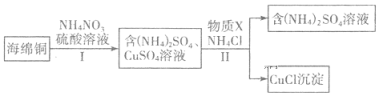
①步骤I中反应温度不宜过高的原因是______,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为 ______________。
②步骤Ⅱ中物质X可选用____(填字母),该物质需过量的原因,其一是加快反应速率,其二是____________。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
【答案】还原剂Cu+H2O2+2H+=Cu2++2H2O防止生成氮氧化物造成污染4Cu+NO3-+10H+=4Cu2++NH4++3H2Oad防止CuCl被氧化
【解析】
(1)葡萄糖中含有醛基,能够被新制氢氧化铜氧化为羧基,化学方程式为CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O,生成葡萄糖酸和Cu2O,Cu元素化合价降低,被还原,为氢氧化铜为氧化剂,葡萄糖为还原剂,被氧化;正确答案:还原剂。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O,生成葡萄糖酸和Cu2O,Cu元素化合价降低,被还原,为氢氧化铜为氧化剂,葡萄糖为还原剂,被氧化;正确答案:还原剂。
(2)铜在酸性条件下,被双氧水氧化为铜离子,双氧水被还原为水,化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,其离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;正确答案:Cu+H2O2+2H+=Cu2++2H2O。
(3)海绵铜加入硫酸酸化的硝酸铵,由于酸性条件下硝酸根离子具有强氧化性,可氧化铜,因硝酸铵易分解,则加热温度不能太高,经步骤Ⅰ得到硫酸铵和硫酸铜溶液,经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,经过滤可得到CuCl和硫酸铵溶液;
①加热温度不能太高,硝酸根离子可被还原生成氮氧化物,易导致环境污染;0.5molNH4NO3参加反应有4mol电子转移,则N元素被还原为﹣3价,反应的离子方程式为4Cu+NO3﹣+10H+=4Cu2++NH4++3H2O;正确答案:防止生成氮氧化物造成污染;4Cu+NO3-+10H+=4Cu2++NH4++3H2O。
②经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,ad符合;该物质需过量以防止CuCl被氧化;正确答案:ad;防止CuCl被氧化。

【题目】在高温下,Fe 与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe 与水蒸气反应的实验"。请回答该实验中的问题。

(1)写出该反应的化学方程式__________。
(2)实验前必须对整套装置进行的操作是___________;
(3)在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①实验中使用肥皂液的作用是_____________________________。
②甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验。
实验 编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质是__________________________;不能确定是否存在FeO的原因是____________________________________。
③如果黑色粉末是Fe3O4,则黑色粉末和盐酸反应得离子方程式为________________。