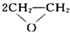题目内容
“十二五”规划中的环保任务是到2015年末,我国的主要污染物二氧化碳比2010年消减10%.某化学兴趣小组设计了用铜和浓硫酸制取SO2,并依次进行检验SO2具有酸性氧化物的性质、还原性、漂白性和氧化性的实验,所用仪器如图所示(图中连接胶管、夹持和加热装置均已省略):

请回答下列问题:
(1)上述装置的接口连接顺序依次是①→______(填导管编号).
(2)装置A中发生反应的化学方程式是______.
(3)证明SO2具有氧化性的现象是______;证明SO2具有还原性的实验中,反应的离子方程式是______.
(4)C试管中NaOH溶液的作用是______,CCl4的作用是______.
(5)某工厂用石灰石--石膏湿法烟气脱硫工艺来降低含硫燃料燃烧排放的SO2,同时获得熟石膏(2CaSO4?H2O),保护了环境.
①该工艺利用了SO2的什么性质?______.
②写出该工艺的化学方程式______.
解:(1)铜和浓硫酸制取SO2,并依次进行检验SO2具有酸性氧化物的性质、还原性、漂白性和氧化性的实验,铜和浓硫酸加热反应生成二氧化硫气体,通过澄清石灰水变浑浊证明二氧化硫是酸性氧化物,通过B装置检验二氧化硫的还原性和漂白性,通过E装置和硫化钠反应生成单质硫证明二氧化硫的氧化性;最后通入氢氧化钠溶液中吸收过量的二氧化硫防止污染空气,二氧化硫不溶于四氯化碳,通入四氯化碳溶液中可以防止倒吸;连接顺序为:⑤→⑥→③→②→⑦→⑧→④,
故答案为:⑤→⑥→③→②→⑦→⑧→④;
(2)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓) CuSO4+2SO2↑+2H2O,
CuSO4+2SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) CuSO4+2SO2↑+2H2O;
CuSO4+2SO2↑+2H2O;
(3)证明二氧化硫具有氧化性的装置是E,和硫化钠反应生成单质硫,反应的化学方程式为SO2+2S2-+2H2O=3S↓+4OH-;证明二氧化硫还原性的装置是利用溴单质和二氧化硫反应,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42-+2Br-,
故答案为:E试管中溶液变浑浊,SO2+Br2+2H2O=4H++SO42-+2Br-
(5)①二氧化硫和碳酸钙反应生成亚硫酸钙证明二氧化硫的酸性,生成的亚硫酸钙被空气中的氧气氧化为硫酸钙,表明了二氧化硫的还原性,
故答案为:酸性、还原性;
②二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4?2H2O,反应的化学方程式为:2CaCO3+2SO2+O2+H2O=2CaSO4?H2O+2CO2,故答案为:2CaCO3+2SO2+O2+H2O=2CaSO4?H2O+2CO2.
分析:(1)铜和浓硫酸制取SO2,并依次进行检验SO2具有酸性氧化物的性质、还原性、漂白性和氧化性的实验,铜和浓硫酸加热反应生成二氧化硫气体,通过澄清石灰水变浑浊证明二氧化硫是酸性氧化物,通过B装置检验二氧化硫的还原性和漂白性,通过E装置和硫化钠反应生成单质硫证明二氧化硫的氧化性;最后通入氢氧化钠溶液中吸收过量的二氧化硫防止污染空气,二氧化硫不溶于四氯化碳,通入四氯化碳溶液中可以防止倒吸;
(2)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(3)证明二氧化硫具有氧化性的装置是E,和硫化钠反应生成单质硫;证明二氧化硫还原性的装置是利用溴单质和二氧化硫反应;
(5)①二氧化硫和碳酸钙反应生成亚硫酸钙证明二氧化硫的酸性,生成的亚硫酸钙被空气中的氧气氧化为硫酸钙,表明了二氧化硫的还原性;
②二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4?2H2O.
点评:本题考查了物质性质的实验验证方法和实验装置选择,物质性质和装置选择是解题关键,题目难度中等.
故答案为:⑤→⑥→③→②→⑦→⑧→④;
(2)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
 CuSO4+2SO2↑+2H2O,
CuSO4+2SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
 CuSO4+2SO2↑+2H2O;
CuSO4+2SO2↑+2H2O;(3)证明二氧化硫具有氧化性的装置是E,和硫化钠反应生成单质硫,反应的化学方程式为SO2+2S2-+2H2O=3S↓+4OH-;证明二氧化硫还原性的装置是利用溴单质和二氧化硫反应,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42-+2Br-,
故答案为:E试管中溶液变浑浊,SO2+Br2+2H2O=4H++SO42-+2Br-
(5)①二氧化硫和碳酸钙反应生成亚硫酸钙证明二氧化硫的酸性,生成的亚硫酸钙被空气中的氧气氧化为硫酸钙,表明了二氧化硫的还原性,
故答案为:酸性、还原性;
②二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4?2H2O,反应的化学方程式为:2CaCO3+2SO2+O2+H2O=2CaSO4?H2O+2CO2,故答案为:2CaCO3+2SO2+O2+H2O=2CaSO4?H2O+2CO2.
分析:(1)铜和浓硫酸制取SO2,并依次进行检验SO2具有酸性氧化物的性质、还原性、漂白性和氧化性的实验,铜和浓硫酸加热反应生成二氧化硫气体,通过澄清石灰水变浑浊证明二氧化硫是酸性氧化物,通过B装置检验二氧化硫的还原性和漂白性,通过E装置和硫化钠反应生成单质硫证明二氧化硫的氧化性;最后通入氢氧化钠溶液中吸收过量的二氧化硫防止污染空气,二氧化硫不溶于四氯化碳,通入四氯化碳溶液中可以防止倒吸;
(2)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(3)证明二氧化硫具有氧化性的装置是E,和硫化钠反应生成单质硫;证明二氧化硫还原性的装置是利用溴单质和二氧化硫反应;
(5)①二氧化硫和碳酸钙反应生成亚硫酸钙证明二氧化硫的酸性,生成的亚硫酸钙被空气中的氧气氧化为硫酸钙,表明了二氧化硫的还原性;
②二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4?2H2O.
点评:本题考查了物质性质的实验验证方法和实验装置选择,物质性质和装置选择是解题关键,题目难度中等.

练习册系列答案
相关题目