题目内容
【题目】某同学设计如下实验装置用于制取纯净的无水FeCl3.
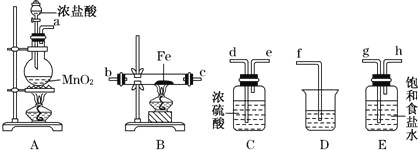
(1)图中盛放浓盐酸的实验仪器的名称为 ,A中发生反应的化学方程式为 .
(2)各装置的正确连接顺序为:a→ → → → → →c→ (填字母代号),
(3)装置E的作用是 ,装置C的作用是 .
(4)装置D中所发生反应的离子方程式为 .
(5)装置A中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl的质量为 .
【答案】(1)分液漏斗;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)g;h;d;e;b;f;
(3)除去氯气中的氯化氢;干燥氯气;
(4)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
(5)7.3g
【解析】
试题分析:该实验目的是用Cl2和Fe反应制取FeCl3固体,实验室用浓盐酸和MnO2加热制取Cl2,因为要制取纯净干燥的FeCl3,所以生成的Cl2必须是干燥、纯净的,浓盐酸、水都具有挥发性,所以生成的Cl2中含有HCl、H2O,用饱和食盐水除去HCl、用浓硫酸干燥Cl2,氯气有毒,不能直接排空,应该用碱液吸收Cl2;
(1)图中盛放浓盐酸的实验仪器的名称为分液漏斗,实验室用浓盐酸和MnO2加热制取Cl2,二者反应生成氯化锰、氯气和水;
(2)各装置的正确连接顺序为气体制备装置、洗气装置、干燥装置、氯化铁制备装置、尾气处理装置,
(3)装置E的作用是吸收HCl,装置C的作用是干燥气体;
(4)装置D中氯气和碱反应生成氯化物、次氯酸盐和水;
(5)装置A中,如果反应产生氯气的体积为2.24L(标准状况),其物质的量=![]() =0.1mol,根据Cl原子守恒计算反应中被氧化的HCl的物质的量,根据m=nM计算被氧化硫化氢质量.
=0.1mol,根据Cl原子守恒计算反应中被氧化的HCl的物质的量,根据m=nM计算被氧化硫化氢质量.
解:该实验目的是用Cl2和Fe反应制取FeCl3固体,实验室用浓盐酸和MnO2加热制取Cl2,因为要制取纯净干燥的FeCl3,所以生成的Cl2必须是干燥、纯净的,浓盐酸、水都具有挥发性,所以生成的Cl2中含有HCl、H2O,用饱和食盐水除去HCl、用浓硫酸干燥Cl2,氯气有毒,不能直接排空,应该用碱液吸收Cl2;
(1)图中盛放浓盐酸的实验仪器的名称为分液漏斗,实验室用浓盐酸和MnO2加热制取Cl2,二者反应生成氯化锰、氯气和水,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:分液漏斗;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:分液漏斗;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)各装置的正确连接顺序为气体制备装置、洗气装置、干燥装置、氯化铁制备装置、尾气处理装置,所以其连接顺序是a→g→h→d→e→b→c→f,
故答案为:g;h;d;e;b;f;
(3)装置E的作用是吸收挥发出的HCl,装置C的作用是干燥气体,防止得不到干燥的氯化铁,故答案为:除去氯气中的氯化氢;干燥氯气;
(4)装置D中氯气和碱反应生成氯化物、次氯酸盐和水,离子方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,故答案为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
(5)装置A中,如果反应产生氯气的体积为2.24L(标准状况),其物质的量=![]() =0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,被氧化m(HCl)=nM=0.2mol×36.5g/mol=7.3g,故答案为:7.3g
=0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,被氧化m(HCl)=nM=0.2mol×36.5g/mol=7.3g,故答案为:7.3g

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案