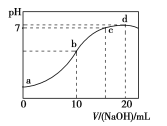
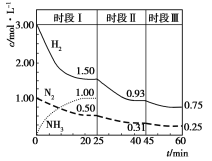
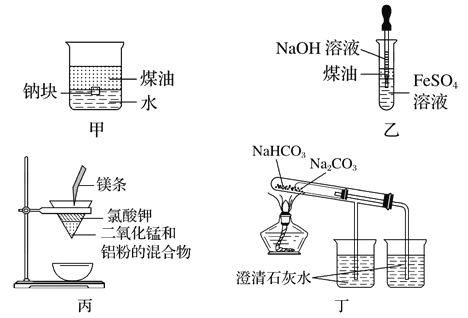
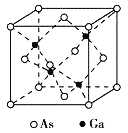
题目内容
【题目】下列物质中在一定条件下能够导电,但不属于电解质的是
A. 石墨 B. KNO3 C. H2SO4 D. 蔗糖
【答案】A
【解析】
电解质、非电解质均是化合物,电解质是一定条件下本身电离而导电的化合物;导电的物质不一定是电解质,以此分析解决此题。
A项,石墨能导电,属于单质,既不是电解质又不是非电解质;
B项,KNO3属于盐,在水溶液里、熔融时都能导电,属于电解质;
C项,H2SO4属于酸,在水溶液里电离产生氢离子和硫酸根离子能导电,属于电解质;
D项,蔗糖属于非电解质,不导电。
综上所述,符合题意的选项为A。

【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
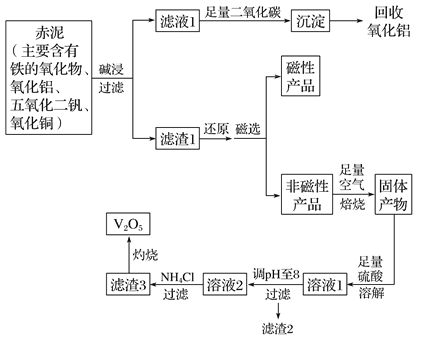
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
【题目】下表是3种物质的溶解度(20℃),下列说法中不正确的是
物 质 | MgCl2 | Mg(OH)2 | MgCO3 |
溶解度(g/100g) | 74 | 0.00084 | 0.01 |
A. 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
B. 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH溶液
C. 已知MgCO3的Ksp=6.82×10-6mol2/L2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)×c(CO32-)=6.82×10-6mol2/L2
D. 用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:
Mg2++2HCO3-+2Ca2++4OH-===2CaCO3↓+Mg(OH)2↓+2H2O