题目内容
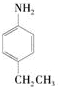
(2011?安徽)室温下,下列各组离子在指定溶液中能大量共存的是( )
分析:根据溶液中的成分,若离子之间结合生成水、气体、沉淀、弱电解质,以及离子之间发生氧化还原反应则不能大量共存于溶液中来分析解答.
解答:解:A、由Cl2和水反应生成盐酸和次氯酸,则饱和氯水中含有H+和HClO等微粒,H+与SO32-结合生成水和二氧化硫,且在酸性条件下HClO与SO32-发生氧化还原反应,则该组离子不能大量共存,故A错误;
B、c(H+)=1.0×10-13mol?L-1溶液中,氢离子浓度小于1.0×10-7mol?L-1,则溶液为碱的溶液,在碱溶液中能共存,故B正确;
C、因Na2S溶液中S2-与Cu2+结合生成沉淀,则该组离子一定不能大量共存,故C错误;
D、因pH=12的溶液中OH-较多,则OH-与Al3+反应生成AlO2-离子,则该组离子一定不能共存,故D错误;
故选B.
B、c(H+)=1.0×10-13mol?L-1溶液中,氢离子浓度小于1.0×10-7mol?L-1,则溶液为碱的溶液,在碱溶液中能共存,故B正确;
C、因Na2S溶液中S2-与Cu2+结合生成沉淀,则该组离子一定不能大量共存,故C错误;
D、因pH=12的溶液中OH-较多,则OH-与Al3+反应生成AlO2-离子,则该组离子一定不能共存,故D错误;
故选B.
点评:本题考查离子的共存问题,明确离子之间复分解反应发生的条件,能判断常见的弱电解质及离子之间能否发生氧化还原反应、相互促进水解反应等知识点即可解答.

练习册系列答案
相关题目
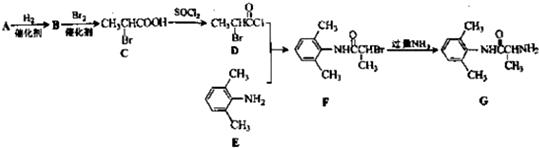
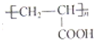 的单体,则A中含有的官能团是
的单体,则A中含有的官能团是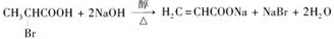
 、
、