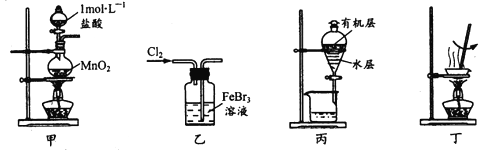
题目内容
【题目】关于硝酸的说法中正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体
D.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色
【答案】C
【解析】
A.硝酸具有强氧化性,与Zn反应生成氮氧化物等,不能生成H2,故A错误;
B.Fe被浓硝酸钝化,阻止进一步反应,故B错误;
C.稀H2SO4电离出H+,NO![]() 在酸性条件下具有强氧化性,被Fe2+还原为NO,试管口遇O2生成红棕色的NO2,故C正确;
在酸性条件下具有强氧化性,被Fe2+还原为NO,试管口遇O2生成红棕色的NO2,故C正确;
D.过量的Fe粉中加入稀HNO3,生成Fe2+,与KSCN溶液不反应,无明显现象,故D错误;
故选:C。

【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=________kJ/mol(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8 mol CO2(g)、16 mol H2(g) |
乙 | w mol CO2(g)、x mol H2(g)、y mol CO(g)、z mol H2O(g) |
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0~15 min内平均反应速率v(H2)=______,此条件下该反应的平衡常数K=______。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是:y______z(填“>”、“<”或“=”),且y=______(用含x、w的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:

则△H_____0(填“>”、“<”或“=”),压强p1、p2、p3从大到小的顺序是________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。