题目内容
14.下列反应的离子方程式不正确的是( )| A. | 铁与盐酸反应:2Fe+6H+=2Fe3++H2↑ | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+=H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
分析 A.铁与盐酸反应生成的是氯化亚铁;
B.氢氧化钠与盐酸反应生成氯化钠和水;
C.锌与硫酸铜溶液反应生成硫酸锌和铜;
D.氯化钡与稀硫酸反应生成硫酸钡沉淀和可溶性的氯化钠.
解答 解:A.铁与盐酸反应生成氯化亚铁和氢气,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故A错误;
B.氢氧化钠溶液与盐酸反应的离子方程式为:OH-+H+=H2O,故B正确;
C.锌与硫酸铜溶液反应的离子方程式为:Zn+Cu2+=Zn2++Cu,故C正确;
D.氯化钡溶液与稀硫酸反应生成硫酸钡沉淀和氯化钠,反应的离子方程式为:Ba2++SO42-=BaSO4↓,故D正确;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
4.SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=H2O+SO32-.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
1表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-?H++SO32-,显酸性是因其电离大于其水解
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO${\;}_{3}^{-}$)+c(HSO${\;}_{3}^{2-}$)
b.c(Na-)>c(HSO${\;}_{3}^{-}$)>c(SO${\;}_{3}^{2-}$)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO${\;}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-)
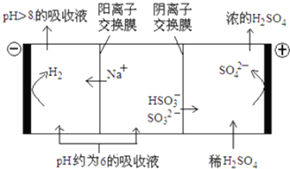
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3--2e-+H2O=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生.

(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=H2O+SO32-.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO${\;}_{3}^{-}$)+c(HSO${\;}_{3}^{2-}$)
b.c(Na-)>c(HSO${\;}_{3}^{-}$)>c(SO${\;}_{3}^{2-}$)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO${\;}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3--2e-+H2O=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生.
5.水中加入下列溶液对水的电离平衡不产生影响的是( )
| A. | NaHSO4溶液 | B. | KF溶液 | C. | KAl(SO4)2溶液 | D. | NaI溶液 |
2.下列表示物质结构的化学用语或模型正确的是( )
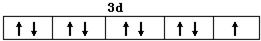
| A. | C原子外围电子排布图: | B. | 硫原子结构示意图: | ||
| C. | 二氧化硅的分子式:SiO2 | D. | Na的电子排布式:1s22s22p63s1 |
9.下列说法正确的是( )
| A. | 18 g H2O在标准状况下的体积是22.4 L | |
| B. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| C. | 在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3 | |
| D. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L |
6.m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是( )
| A. | 沉淀中OH-的质量为(n-m)g | |
| B. | 恰好溶解后溶液中的NO$\frac{-}{3}$的物质的量为aVmol | |
| C. | 反应过程中转移的电子的物质的量为$\frac{n-m}{17}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{aV}{1000}$)mol |
4.下列有关化学实验的叙述正确的是( )
| A. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| B. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 | |
| C. | 实验室可以用湿润的淀粉KI试纸鉴别二氧化氮和溴蒸气 | |
| D. | 从碘的CCl4溶液获得单质碘的实验方法是蒸馏 |

 .
.