题目内容
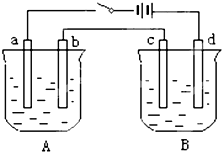
 用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | CuCl2 |
| 3 | Na2SO4 | AgNO3 |
| 4 | NaCl | AgNO3 |
②b、c两极上反应的离子的物质的量相等.
(1)应选择的电解质是上述四组中的第
(2)该组电解过程中各电极上的电极反应式为:
a极
(3)当b极上析出7.1g电解产物时,a极上析出产物的质量为
1组、A槽是电解水,氢氧化钠溶液PH增大,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硫酸铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e-=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等:
2组、A槽是电解硝酸银,溶液PH减小,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解氯化铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e-=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等:
3组、A槽是电解水,硫酸钠溶液PH不变,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e-=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等:
4组、A槽是电解氯化钠,氯化钠溶液PH增大,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e-=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等:
依据电极反应和电极过程中溶液PH变化分析判断;
2组、A槽是电解硝酸银,溶液PH减小,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解氯化铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e-=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等:
3组、A槽是电解水,硫酸钠溶液PH不变,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e-=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等:
4组、A槽是电解氯化钠,氯化钠溶液PH增大,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e-=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等:
(1)依据上述分析可知,符合条件的是滴4组;故答案为:4;
(2)该组电解过程中各电极上的电极反应式为:a、4H++4e-=2H2↑;b、4Cl--4e-=2Cl2↑;c、4Ag++4e-=4Ag;d、4OH--4e-=2H2O+O2↑;
故答案为:4H++4e-=2H2↑;4Cl--4e-=2Cl2↑;4Ag++4e-=4Ag;4OH--4e-=2H2O+O2↑;
(3)a、4H++4e-=2H2↑;b、4Cl--4e-=2Cl2↑;当b极上析出7.1g电解产物为氯气物质的量为0.1mol,a极上析出产物为氢气,氢气的物质的量为0.1mol,氢气的质量为0.1mol×2g/mol=0.2g;若B槽电解质溶液500mL,且忽略电解前后电解液的体积变化,电解过程中氢氧根离子减少和氢离子增加相同,依据电子守恒和电极反应可以计算得到,4OH--4e-=2H2O+O2↑电子转移0.2mol消耗氢氧根离子0.2mol,溶液中增加氢离子为0.2mol,则此时B槽中的c(H+)比电解前增加了
| 0.2mol |
| 0.5L |
故答案为:2g;0.4;

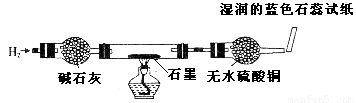
(12分)某校课外兴趣小组用如图装置进行电解CuC12溶液的实验。实验时,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究:
(1)阳极产物探究。
根据实验现象,同学们对阳极发生的电极反应提出了如下假设:
假设1 ;
假设2 。
请你设计实验方案证明你的假设(包括:操作→现象→结论): 。
(2)阴极产物探究:
| 查阅资料 | 铜和铜的化合物中Cu、Cu2O为红色,CuCl、CuBr、CuI为白色,它们在水中均不溶,且稳定存在。 |
| 探究实验 | 取出阴极碳棒,并将其干燥,然后用如图所示装置(气密性良好,药品性能良好)进行实验并记录现象:
现象:碳棒上红色物质依然存在;白色物质变为红色;无水硫酸铜仍为白色;蓝色石蕊试纸变为红色 |
结论与解释:
①白色物质为 。
②某学生收集碳棒上的白色物质并装入试管中,滴人稀HNO3,写出白色物质与稀HNO3反应的离子方程式: 。
(12分)某校课外兴趣小组用如图装置进行电解CuC12溶液的实验。实验时,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究:
(1)阳极产物探究。
根据实验现象,同学们对阳极发生的电极反应提出了如下假设:
假设1 ;
假设2 。
请你设计实验方案证明你的假设(包括:操作→现象→结论): 。
(2)阴极产物探究:
|
查阅资料 |
铜和铜的化合物中Cu、Cu2O为红色,CuCl、CuBr、CuI为白色,它们在水中均不溶,且稳定存在。 |
|
探究实验 |
取出阴极碳棒,并将其干燥,然后用如图所示装置(气密性良好,药品性能良好)进行实验并记录现象:
现象:碳棒上红色物质依然存在;白色物质变为红色;无水硫酸铜仍为白色;蓝色石蕊试纸变为红色 |
结论与解释:
①白色物质为 。
②某学生收集碳棒上的白色物质并装入试管中,滴人稀HNO3,写出白色物质与稀HNO3反应的离子方程式: 。
| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | CuCl2 |
| 3 | Na2SO4 | AgNO3 |
| 4 | NaCl | AgNO3 |
②b、c两极上反应的离子的物质的量相等.
(1)应选择的电解质是上述四组中的第______组.
(2)该组电解过程中各电极上的电极反应式为:
a极______;b极______;c极______;d极______.
(3)当b极上析出7.1g电解产物时,a极上析出产物的质量为______g;若B槽电解质溶液500mL,且忽略电解前后电解液的体积变化,则此时B槽中的c(H+)比电解前增加了______mol/L.