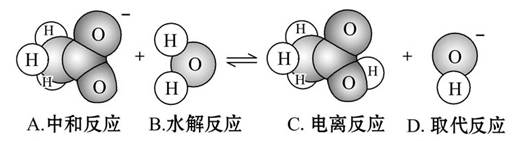
题目内容
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A.若pH>7,则一定是c1V1=c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2,c2=c1,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
A
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。下列叙述错误的是
| A.混合溶液可能显示酸性、碱性或中性 |
| B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O) |
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为 mol·L-1 mol·L-1 |
25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 |
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 |
C.BaSO4和BaCO3共存的悬浊液中,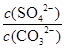 = = |
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24。下列说法正确的是( )
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1 |
| C.因为H2SO4是强酸,故CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
| A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)??CuS(s)+Mn2+(aq),下列说法错误的是( )
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K= |