��Ŀ����
����Ŀ���ش��������⣺
��1����֪25��ʱNH3��H2O��Kb=2.0 10-5
����0.10 mol/L�� NH3��H2O��c(OH-)=______________mol/L
���������м������NH4Cl��ʹc(NH4+)��Ũ�ȴﵽ0.20 mol/L����c(OH-)=________mol/L
��25��ʱ����a molL-1�İ�ˮ��0.01molL-1�������������������Ϻ���Һ��pH��7���ú�a�Ĵ���ʽ��ʾNH3H2O�ĵ��볣��Kb= ___________________ ��
��2��25��ʱ��0.10molL��1��HA��Һ��c��H+��/c��OH����=1010��
�ٸ�HA��Һ��pH=________��
��25��ʱ������Ũ�ȵ�����İ�ˮ��HA��Һ����, �û����Һ��pH________7������������������������=����
���𰸡� 1.410-3 ��![]() 10-3 1 10-5
10-3 1 10-5 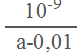 2 ��
2 ��
����������1����NH3H2ONH4++OH-��![]() ��Kb=2.0 ��10-5��Kb=
��Kb=2.0 ��10-5��Kb=![]() =
=![]() =2.0 ��10-5��
=2.0 ��10-5��![]() =
=![]() ��10-3mol/L=1.4��10-3mol/L����Kb=
��10-3mol/L=1.4��10-3mol/L����Kb=![]() =
=![]() =2.0 ��10-5����ã�
=2.0 ��10-5����ã�![]() = 1 ��10-5 mol/L������25���£�ƽ��ʱ��Һ��c��NH4+��=c��Cl-��=0.005mol/L�����������غ��n��NH3H2O��=��0.5a-0.005��mol/L�����ݵ���غ��c��H+��=c��OH-��=10-7mol/L����Һ�����ԣ�NH3H2O�ĵ��볣��Kb=
= 1 ��10-5 mol/L������25���£�ƽ��ʱ��Һ��c��NH4+��=c��Cl-��=0.005mol/L�����������غ��n��NH3H2O��=��0.5a-0.005��mol/L�����ݵ���غ��c��H+��=c��OH-��=10-7mol/L����Һ�����ԣ�NH3H2O�ĵ��볣��Kb=![]() =
=![]() =
=![]() ����2���ٳ����£�ˮ�����ӻ�Kw=c��H+��c��OH-��=10-14����
����2���ٳ����£�ˮ�����ӻ�Kw=c��H+��c��OH-��=10-14����![]() =1010�����c��H+��=10-2mol/L����pH=2����0.10molL��1��HA��ҺpH=2��֤��ΪHA���ᣬ25��ʱ������Ũ�ȵ�����İ�ˮ��HA��Һ���ϣ�������ҺΪNH4A��Һ�����ڣ�Kb=2.0 ��10-5��Ka=
=1010�����c��H+��=10-2mol/L����pH=2����0.10molL��1��HA��ҺpH=2��֤��ΪHA���ᣬ25��ʱ������Ũ�ȵ�����İ�ˮ��HA��Һ���ϣ�������ҺΪNH4A��Һ�����ڣ�Kb=2.0 ��10-5��Ka=![]() =
=![]() =10-3��Kb< Ka,��HA��ĵ������NH3��H2O�ĵ��룬NH4A��Һ�����ԣ�pH��7��
=10-3��Kb< Ka,��HA��ĵ������NH3��H2O�ĵ��룬NH4A��Һ�����ԣ�pH��7��

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
