题目内容
实验室用浓盐酸和二氧化锰反应制取氯气时,收集到7.1 g氯气。求:
(1)发生反应的二氧化锰的物质的量是多少?
(2)被氧化的氯化氢的物质的量是多少?
(3)有多少个电子发生转移?
(1)发生反应的二氧化锰的物质的量是多少?
(2)被氧化的氯化氢的物质的量是多少?
(3)有多少个电子发生转移?
(1)MnO2+4HCl(浓)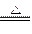 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 mol 71 g
n(MnO2) 7.1 g
n(MnO2)=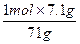 ="0.1" mol
="0.1" mol
(2)被氧化的HCl的物质的量等于被氧化的Cl-的物质的量。
MnO2+2Cl-+4H+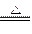 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
2 mol 71 g
n(Cl-) 7.1 g
n(Cl-)=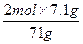 ="0.2" mol
="0.2" mol
(3)每生成1 mol Cl2,电子转移的数目为2×6.02×1023个。
Cl2 — 2e-
71 g2×6? 0.2×1023个
7.1 g? N
N=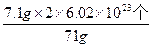 =1.204×1023个
=1.204×1023个
答:(1)反应的MnO2为0.1 mol。
(2)被氧化的HCl为0.2 mol。
(3)电子转移数为1.204×1023个。
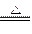 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O1 mol 71 g
n(MnO2) 7.1 g
n(MnO2)=
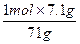 ="0.1" mol
="0.1" mol(2)被氧化的HCl的物质的量等于被氧化的Cl-的物质的量。
MnO2+2Cl-+4H+
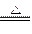 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O2 mol 71 g
n(Cl-) 7.1 g
n(Cl-)=
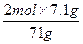 ="0.2" mol
="0.2" mol(3)每生成1 mol Cl2,电子转移的数目为2×6.02×1023个。
Cl2 — 2e-
71 g2×6? 0.2×1023个
7.1 g? N
N=
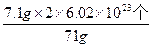 =1.204×1023个
=1.204×1023个答:(1)反应的MnO2为0.1 mol。
(2)被氧化的HCl为0.2 mol。
(3)电子转移数为1.204×1023个。
MnO2与浓HCl反应的化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
该反应既是氧化还原反应,又是离子反应,离子方程式及电子转移情况为:
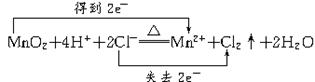
由此可知:参加离子反应的Cl-代表了被氧化的HCl,化学反应中生成的Cl2的质量与被
氧化HCl的物质的量、电子转移数目、反应的MnO2的质量之间存在正比例关系。故本题的题型属于物质的量应用于化学方程式计算型,可以采用解物质的量应用于化学方程式计算题的一般方法步骤求解。
MnO2+4HCl(浓)
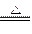 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O该反应既是氧化还原反应,又是离子反应,离子方程式及电子转移情况为:

由此可知:参加离子反应的Cl-代表了被氧化的HCl,化学反应中生成的Cl2的质量与被
氧化HCl的物质的量、电子转移数目、反应的MnO2的质量之间存在正比例关系。故本题的题型属于物质的量应用于化学方程式计算型,可以采用解物质的量应用于化学方程式计算题的一般方法步骤求解。

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
 )依次为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,(设混合液的体积为各溶液体积之和)则K2SO4溶液、Fe2(SO4)3溶液及水混合时体积比是( )
)依次为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,(设混合液的体积为各溶液体积之和)则K2SO4溶液、Fe2(SO4)3溶液及水混合时体积比是( )