题目内容
完成下列2个小题:(1)配平下列反应方程式
(2)用双线桥标出下列反应的电子转移方向和数目:S+2H2SO4(浓)
| ||
该反应中氧化剂是
分析:(1)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据电子守恒、原子守恒配平方程式;
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,化合价降低元素所在的反应物是氧化剂,对应产物是还原产物,氧化剂具有氧化性,化合价升高元素所在的反应物是还原剂,对应产物是氧化产物,还原剂具有还原性.
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,化合价降低元素所在的反应物是氧化剂,对应产物是还原产物,氧化剂具有氧化性,化合价升高元素所在的反应物是还原剂,对应产物是氧化产物,还原剂具有还原性.
解答:解:(1)Mn元素的化合价是从+7价降低到了+2价,降低了5,硫元素的化合价从+4价升高到了+6价,升高了2价,所以Mn元素前边系数是2,SO2前边系数是5,根据原子守恒,硫酸锰前边系数是2,硫酸钾系数是1,水前边系数是2,
故答案为:2、5、2、2、1、2;
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数=4,化合价降低元素S元素,化合价从+6降到了+4价,S元素化合价也从0价升高到了+4价,电子转移情况如下: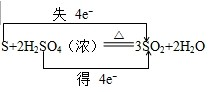 ,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,
,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,
故答案为: ;H2SO4;还原;还原;1:2.
;H2SO4;还原;还原;1:2.
故答案为:2、5、2、2、1、2;
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数=4,化合价降低元素S元素,化合价从+6降到了+4价,S元素化合价也从0价升高到了+4价,电子转移情况如下:
 ,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,
,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,故答案为:
 ;H2SO4;还原;还原;1:2.
;H2SO4;还原;还原;1:2.点评:本题考查氧化还原反应的特征和实质以及化学方程式的电子转移知识,是对教材知识的考查,难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目

 各空:
各空: CH3COOH溶液稀释100倍后所得
CH3COOH溶液稀释100倍后所得 溶液pH a +2(填“>”或“<”)
溶液pH a +2(填“>”或“<”) 。
。 理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)