题目内容
在473K时,反应PCl5(g) PCl3(g)+Cl2(g)的K=4.6×10-3mol·L-1。
PCl3(g)+Cl2(g)的K=4.6×10-3mol·L-1。
⑴若PCl5初始浓度为0.020 mol·L-1。求PCl5的转化率。
⑵PCl5初始浓度为多大时,PCl5的转化率为50%?
 PCl3(g)+Cl2(g)的K=4.6×10-3mol·L-1。
PCl3(g)+Cl2(g)的K=4.6×10-3mol·L-1。⑴若PCl5初始浓度为0.020 mol·L-1。求PCl5的转化率。
⑵PCl5初始浓度为多大时,PCl5的转化率为50%?
⑴PCl5的转化率为38%;⑵PCl5初始浓度为9.2×10-3mol·L-1时,PCl5的转化率为50%。
解答此类题目时,通常将反应物的转化率设为x,结合反应的化学方程式,各个物质的平衡浓度用含x的表达式表示出来,通过相应的平衡常数表达式列出方程,解方程得x的值,从而求得反应物的转化率。
⑴设平衡时的PCl5转化浓度为x,
PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
初始浓度(mol·L-1) 0.020 0 0
转化浓度(mol·L-1) x x x
平衡浓度(mol·L-1) 0.020-x x x
又由平衡常数K=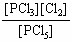
即: 4.6×10-3mol·L-1=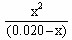
解得: x=7.6×10-3mol·L-1
PCl5的转化率为: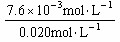 ×100%=38%
×100%=38%
⑵设PCl5初始浓度为c时,PCl5的转化率为50%。
PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
初始浓度(mol·L-1) c 0 0
转化浓度(mol·L-1) 0.5c 0.5c 0.5c
平衡浓度(mol·L-1) c-0.5c 0.5c 0.5c x
又由平衡常数K=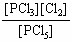
即: 4.6×10-3mol·L-1=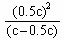
解得: c=9.2×10-3mol·L-1
⑴设平衡时的PCl5转化浓度为x,
PCl5(g)
 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)初始浓度(mol·L-1) 0.020 0 0
转化浓度(mol·L-1) x x x
平衡浓度(mol·L-1) 0.020-x x x
又由平衡常数K=
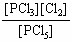
即: 4.6×10-3mol·L-1=
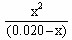
解得: x=7.6×10-3mol·L-1
PCl5的转化率为:
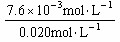 ×100%=38%
×100%=38%⑵设PCl5初始浓度为c时,PCl5的转化率为50%。
PCl5(g)
 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)初始浓度(mol·L-1) c 0 0
转化浓度(mol·L-1) 0.5c 0.5c 0.5c
平衡浓度(mol·L-1) c-0.5c 0.5c 0.5c x
又由平衡常数K=
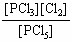
即: 4.6×10-3mol·L-1=
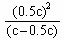
解得: c=9.2×10-3mol·L-1

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 xC(g)有如下图(a)、(b)所示的关系曲线,试判断下列对图(b)的说法正确的是 ( )
xC(g)有如下图(a)、(b)所示的关系曲线,试判断下列对图(b)的说法正确的是 ( )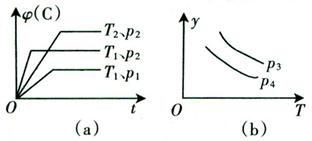
 bR(g)达到平衡后,温度和压强对该反应的影响如下图所示,图中压强p1> p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡后,温度和压强对该反应的影响如下图所示,图中压强p1> p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( ) 
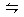 3C(g)+2D(g)
3C(g)+2D(g) 2SO3(g);△H<0的实验数据如下表:
2SO3(g);△H<0的实验数据如下表:


 等于___________________________;
等于___________________________;