题目内容
5.下列说法不正确的是( )| A. | 当7.8 g Na2O2与H2O完全反应时,有0.1 mol电子发生了转移 | |
| B. | FeCl2溶液与NaOH溶液混合,利用此反应可检验Fe2+ | |
| C. | 用浓盐酸酸化KMnO4溶液以增强其氧化性 | |
| D. | 在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为1:2 |
分析 A、Na2O2与水的反应为歧化反应,1molNa2O2转移1mol电子;
B、FeCl2溶液与NaOH溶液混合先生成白色沉淀的氢氧化亚铁沉淀,后被氧化转变成灰绿色,最后变成红褐色沉淀;
C、KMnO4溶液氧化浓盐酸;
D、该反应中N元素的化合价由+4价变为+5价和+2价,所以二氧化氮既是氧化剂又是还原剂,据此分析.
解答 解:A、Na2O2与水的反应为歧化反应,1molNa2O2转移1mol电子,则当7.8 g Na2O2与H2O完全反应时,有0.1 mol电子发生了转移,故A正确;
B、FeCl2溶液与NaOH溶液混合先生成白色沉淀的氢氧化亚铁沉淀,后被氧化转变成灰绿色,最后变成红褐色沉淀,所以利用此反应可检验Fe2+,故B正确;
C、KMnO4溶液氧化浓盐酸,所以不能用浓盐酸酸化KMnO4溶液以增强其氧化性,故C错误;
D、该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸的二氧化氮是还原剂,其计量数是2,生成NO的二氧化氮是氧化剂,其计量数是1,所以氧化剂和还原剂的物质的量、质量之比都是1:2,故D正确.
故选C
点评 本题考查了阿伏伽德罗常数的有关计算、二价铁的检验以及氧化还原反应,难度不大,注意基础知识的应用.

练习册系列答案
相关题目
5.设NA为阿伏加徳罗常数数值,下列有关叙述正确的是( )
| A. | 将78g Na2O2与过量CO2反应转移的电子数为2NA | |
| B. | 1molN2与4mol H2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,2.24LCCl4中所含原子数为0.5NA | |
| D. | 标准状况下,18gD2O中所含电子数为9NA |
20.反应A(g)+3B(g)=2C(g)+2D(g),不同情况下测得反应速率,其中反应速率最快的是( )
| A. | υ(D)=0.4 mol/(L•s) | B. | υ(C)=30 mol/(L•min) | C. | υ(B)=0.9 mol/(L•s) | D. | υ(A)=0.15 mol/(L•s) |
17.下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | B. | Na2CO3+H2SO4;Na2CO3+HCl | ||
| C. | CaCO3+H2SO4;CaCO3+HCl | D. | BaCl2+H2SO4;Ba(OH)2+H2SO4 |
14.X、Y、Z、M、W、N六种元素的原子序数依次增大,其中X、Y、Z、M、W为五种短周期元素.X元素的某种核素无中子,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示,N是用量最多的金属元素.下列说法不正确的是( )
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | N的一种氧化物可用作油漆和涂料 | |
| C. | 热稳定性:XM>X2Z | |
| D. | X2Z、WM4分子中各原子最外层均为8电子稳定结构 |
15.化学与生产、生活、环境密切相关.下列有关说法正确的是( )
| A. | 酸雨的pH在5.6~7.0之间 | B. | 向海水中加入明矾可以使海水淡化 | ||
| C. | 硅太阳能电池与原电池的原理相同 | D. | CO2和CH4均能引起温室效应 |
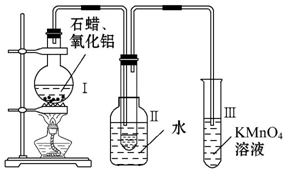 某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.