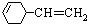题目内容
请按要求填空:(1)下列关于化学实验操作或实验安全的叙述正确的是________________(填序号)
①称取一定质量的NaOH固体,应将NaOH置于已知质量的玻璃器皿中进行;
②测定未知溶液的pH,pH试纸先用蒸馏水润湿;
③酸碱中和滴定实验中,选用石蕊试液作指示剂;
④锌粒与稀H2SO4反应速率太小,为加大速率,向反应器内滴加几滴CuSO4溶液;
⑤测定中和热实验中,所用酸、碱必须完全反应生成1 mol水;
⑥不慎将浓硫酸溅入眼中,应立即用大量水冲洗,边洗边眨眼睛;
⑦称量一烧杯的质量,砝码试加的顺序由小到大;
⑧用BaCl2溶液和稀硝酸检验![]() 的存在。
的存在。
(2)CuO被H2还原的产物中可能有红色的Cu2O。若8.0 g CuO被H2已全部还原成红色固体,请以简单实验证明还原产物中是否存在Cu2O。(简要说明操作、现象和结论)
方法1_________________________________;
方法2_________________________________。
(1)①④⑥
(2)方法1:称量红色固体质量,若大于6.4 g,说明存在Cu2O
方法2:取上述红色固体,重复H2还原氧化铜实验,若硬质玻璃管内出现水珠,说明存在Cu2O(其他合理答案也可)
解析:(1)称取NaOH固体,应在已知质量的玻璃器皿中进行(如烧杯、称量瓶)。锌粒与稀H2SO4反应时加入几滴CuSO4溶液,可形成ZnCu原电池,加快反应速度。浓H2SO4溅入眼中,用大量水冲洗,边洗边眨眼睛,以防烧伤眼睛。因此①④⑥正确。
②测pH的pH试纸不能用蒸馏水湿润,否则就等于将溶液稀释了。
③酸碱中和滴定一般用酚酞或甲基橙作指示剂,而石蕊由于其颜色变化不明显而不用。
⑤测定中和热,不一定必须生成1 mol水。
⑦加砝码的顺序应该是由大到小。
⑧用BaCl2和稀HNO3检验![]() ,要防止Cl-干扰。
,要防止Cl-干扰。
(2)8 g CuO若完全生成Cu,Cu的质量应为6.4 g,若有Cu2O生成,则生成物的质量应大于6.4 g,故可用称量生成物的方法来判断产物中是否有Cu2O。若含有Cu2O,也可用检验产物中是否含有O元素的办法,如用H2还原,看试管壁上是否有水珠生成即可。


 +2Ag(NH3)2OH
+2Ag(NH3)2OH +2Ag+3NH3+H2O
+2Ag+3NH3+H2O
 、
、