题目内容
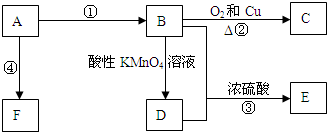
3.请回答如下问题:(1)如图,Ⅰ是甲烷燃料电池(电解质溶液为:KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜.
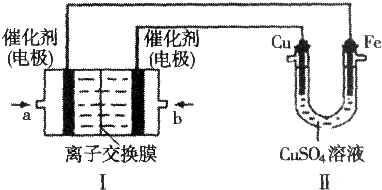
①a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O;
②若实验过程中Ⅱ中的铜片质量减少了2.56g,则Ⅰ中理论上消耗CH4的体积(标准状况)
0.224L;
③若Ⅱ改为用惰性电极电解200mL 0.05mol•L-1的CuSO4溶液,一段时间后溶液中的Cu2+恰好完全析出,恢复至室温,溶液pH=1(忽略电解过程中溶液体积变化);若想将上述电解后的溶液恢复为与电解前的溶液相同,可以加入一定质量的b (填序号);
a.Cu b.CuO C.Cu(OH)2 d.CuSO4
(2)FeCl3溶液具有较强的氧化性,利用FeCl3可以腐蚀印刷电路铜板,其化学方程式为2FeCl3+Cu=CuCl2+2FeCl2,若将此反应设计成原电池,该原电池的负极材料为Cu,正极上的电极反应式为Fe3++e-=Fe2+.
分析 (1)①要实现铁上镀铜,则Cu作阳极、Fe作阴极,I中左边电极为负极、右边电极为正极,燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,所以a处通入的气体是甲烷、b处通入的气体是氧气,a电极上电极反应式为CH4-8e-+10OH-=CO32-+7H2O,b电极上电极反应式为O2+4e-+2H2O=4OH-;
②根据串联电路中转移电子相等计算消耗甲烷体积;
③结合2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,溶液中的Cu2+恰好完全析出计算反应后溶液的pH,电解硫酸铜溶液,要想恢复到与电解前的溶液相同,应加入CuO;
(2)Fe3+有强氧化性,能把金属铜氧化成铜离子;根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液.
解答 解:(1)①要实现铁上镀铜,则Cu作阳极、Fe作阴极,I中左边电极为负极、右边电极为正极,
燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,所以a处通入的气体是甲烷、b处通入的气体是氧气,a电极上电极反应式为CH4-8e-+10OH-=CO32-+7H2O,b电极上电极反应式为O2+4e-+2H2O=4OH-,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②当铜电极质量减去2.56g时,失去电子的物质的量=$\frac{2.56g}{64g/mol}$×2=0.08mol,串联电路中转移电子相等,所以消耗甲烷体积=$\frac{0.08mol}{8}$×22.4L/mol=0.224L,
故答案为:0.224;
③溶液中的Cu2+恰好完全析出,则析出的n(Cu)=0.2L×0.05mol/L=0.01mol,则生成硫酸0.01mol,氢离子为0.02mol,c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,pH=1;电解硫酸铜溶液,溶液中的Cu2+恰好完全析出后,要想恢复到与电解前的溶液相同,应加入CuO,故答案为:1;b;
(2)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2FeCl3+Cu=CuCl2+2FeCl2,设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,
故答案为:2FeCl3+Cu=CuCl2+2FeCl2;Cu;Fe3++e-=Fe2+.
点评 本题考查学生电镀原理以及计算、原电池的构成条件、工作原理以及燃料电池的工作原理知识,注重基础知识的考查,难度不大.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案| A. |  分离碘酒中的碘和酒精 | B. |  用铜和浓硝酸制取少量NO2 | ||
| C. |  比较MnO2、Cl2、I2的氧化性 | D. | 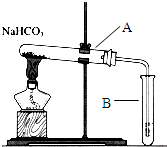 探究NaHCO3的热稳定性 |
| A. | CH2=CH2 | B. | HC≡CH | C. |  | D. | 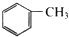 |
| A. | 加成反应 | B. | 消去反应、氧化反应 | ||
| C. | 氧化反应、加成反应 | D. | 加成反应、取代反应 |
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | SiO2晶体中存在四面体结构单元,O处于中心,Si处于4个顶角 |
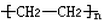 .
.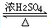 CH3COOC2H5+H2O,反应类型是酯化或取代反应.
CH3COOC2H5+H2O,反应类型是酯化或取代反应.