题目内容
下列变化必须加入还原剂的是( )
| A.NaHCO3→CO2 | B.KClO3→KCl |
| C.FeO→Fe3O4 | D.KMnO4→MnCl2 |
A.元素化合价没有发生变化,不是氧化还原反应,故A错误;
B.无需加入还原剂,在催化剂条件下可自身发生氧化还原反应生成KCl,故B错误;
C.Fe元素化合价升高,需加入氧化剂才能实现,故C错误;
D.Mn元素化合价降低,需加入还原剂才能实现,故D正确.
故选D.
B.无需加入还原剂,在催化剂条件下可自身发生氧化还原反应生成KCl,故B错误;
C.Fe元素化合价升高,需加入氧化剂才能实现,故C错误;
D.Mn元素化合价降低,需加入还原剂才能实现,故D正确.
故选D.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:

(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
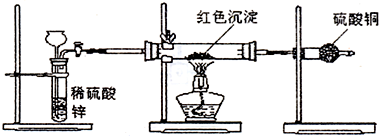
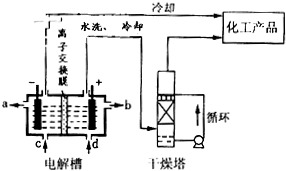
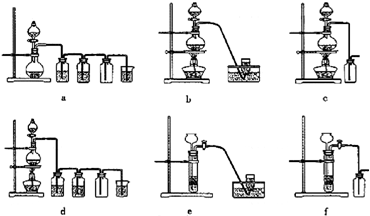
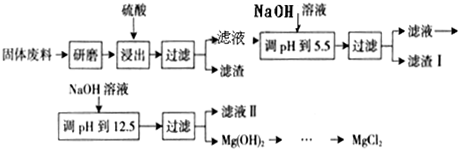

 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)