题目内容
9.下列物质放置在空气中,不是因发生氧化还原反应而发生变质的是( )| A. | Na2SO3 | B. | Na2O2 | C. | NaOH | D. | FeSO4 |
分析 具有还原性的物质,在空气中易被氧气氧化而变质,或与水、二氧化碳反应,以此来解答.
解答 解:A.易被氧化生成硫酸钠而变质,故A不选;
B.Na2O2与水或二氧化碳反应,Na2O2中O元素的化合价变化,为氧化还原反应,故B不选;
C.NaOH与水或二氧化碳反应,无元素的化合价变化,为非氧化还原反应,故C选;
D.硫酸亚铁具有还原性,易被氧气氧化生成硫酸铁,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应为解答关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
19.苯甲酸粗品中含有泥沙和杂质 A(随温度变化 A 的溶解度变化很小),可通过系列操 作完成苯甲酸的提纯.则下列叙述正确的是( )
| A. | 苯甲酸易溶于水,可做食品防腐剂 | |
| B. | 提纯苯甲酸的过程中需要用到的玻璃仪器:烧杯、玻璃棒、漏斗 | |
| C. | 粗品中苯甲酸溶解后,还需再加入少量蒸馏水,以减少产品的损失 | |
| D. | 为了获得更多的苯甲酸,此实验中结晶温度越低越好 |
20. 意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4的沸点比P4(白磷)的高 | |
| C. | 理论上可以将N4转化为N2的反应设计成原电池 | |
| D. | 1mol N4所含有的能量比2mol N2所含有的能量高 |
17.以乙烯为原料生产环氧乙烷,经典的方法是氯代乙醇法,包括以下两步反应:
①CH2=CH2+CI2+H2O→CICH2CH2OH+HCI
②
总的反应可表示为:
现代石油化式采用银作催化剂,可一步完成例:

经典的生产工艺的原子利用率是( )
①CH2=CH2+CI2+H2O→CICH2CH2OH+HCI
②

总的反应可表示为:

现代石油化式采用银作催化剂,可一步完成例:

经典的生产工艺的原子利用率是( )
| A. | 12.7% | B. | 25.4% | C. | 50.8% | D. | 76.2% |
1. 按如图装置进行实验,下列现象及推断正确的是( )
按如图装置进行实验,下列现象及推断正确的是( )
 按如图装置进行实验,下列现象及推断正确的是( )
按如图装置进行实验,下列现象及推断正确的是( )| 选项 | I中试剂 | Ⅱ中试剂及现象 | 推断 |
| A | 氯化铵 | 酚酞溶液变红 | 氯化铵容易分解 |
| B | 亚硫酸氢钠 | 溴水褪色 | SO2气体具有漂白性 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾褪色 | 石蜡油发生了化学变化 |
| D | 高锰酸钾 | 肥皂水冒泡 | 反应生成了氧气 |
| A. | A | B. | B | C. | C | D. | D |
18.部分弱酸的电离平衡常数如表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 | HNO2 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=4.0×10-4 |
| A. | 甲酸和碳酸的分子式中均含两个氢原子,均属于二元酸 | |
| B. | 向NaCN溶液中通入少量的CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HNO2消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |

 +2CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+2CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O +H2O.
+H2O. ).
).

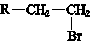
 (R-代表烃基)
(R-代表烃基)