题目内容
【题目】烃A是一种重要的有机化工原料,其相对分子质量Mr(A),90<Mr(A)<110。取一定量A在足量氧气中完全燃烧后,生成的CO2和H2O的物质的量之比为2:1;A能使溴的四氯化碳溶液褪色,红外光谱显示A分子中有苯环。有机物间的转化关系如图:
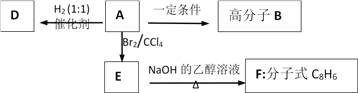
(1)A的实验式为_________;A的相对分子质量为_________;A的官能团的名称为_______________。
(2)A→B的反应方程式为______________________________________。反应类型为______________。
(3)用有机物D的同系物制取炸药TNT的反应方程式为______________________________________。
(4)E→F的反应方程式为__________________________________________。
(5)有机物甲为A的同系物,符合下列两个条件的甲的结构有____种(包括立体异构)。
① 甲的相对分子质量比A大14,②苯环上只有一条侧链。 其中核磁共振氢谱有五组峰,峰面积之比为1:2:2:2:3的物质结构简式为_________________。
【答案】 CH 104 碳碳双键 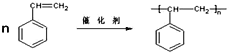 加聚反应
加聚反应 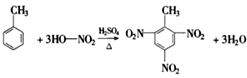
![]() +2NaOH
+2NaOH![]()
 +2NaBr+2H2O 4
+2NaBr+2H2O 4 ![]()
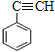
【解析】一定量A在足量氧气中完全燃烧后,生成的CO2和H2O的物质的量之比为2:1;则A中C和H的个数比为1:1,最简式为CH,设A的分子式为CxHx。因为90<Mr(A)<110,则90<13x<110,解得x=7或8,烃中氢原子数目不可能为奇数,C7H7舍去,因此A的分子式为C8H8,A能使溴的四氯化碳溶液褪色,红外光谱显示A分子中有苯环,因此A为苯乙烯(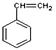 )。根据流程图,B为聚苯乙烯(
)。根据流程图,B为聚苯乙烯(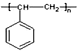 ),E为
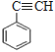
),E为![]() ,F为苯乙炔,D为乙苯。
,F为苯乙炔,D为乙苯。
(1)根据上述分析,A的实验式为CH;A的相对分子质量为13×8=104;A的官能团为碳碳双键,故答案为:CH;104;碳碳双键;
(2)A→B是苯乙烯发生的加聚反应,反应的反应方程式为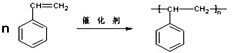 ,故答案为:
,故答案为: ;加聚反应;
;加聚反应;
(3)D为乙苯,用乙苯的同系物制取炸药TNT,该同系物为甲苯,反应方程式为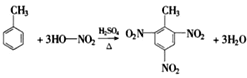 ,故答案为:
,故答案为: ;
;
(4)E→F是卤代烃的洗气反应,反应的方程式为![]() +2NaOH
+2NaOH![]()
 +2NaBr+2H2O,故答案为:
+2NaBr+2H2O,故答案为:![]() +2NaOH
+2NaOH![]()
 +2NaBr+2H2O;
+2NaBr+2H2O;
(5)A为苯乙烯( ),有机物甲为A的同系物。① 甲的相对分子质量比A大14,②苯环上只一条侧链,则满足条件的甲的侧链结构有—CH=CHCH3,—C(CH3)=CH2,—CH2CH=CH2,其中—CH=CHCH3存在立体异构,共4种结构;其中核磁共振氢谱有五组峰,峰面积之比为1:2:2:2:3的物质结构简式为
),有机物甲为A的同系物。① 甲的相对分子质量比A大14,②苯环上只一条侧链,则满足条件的甲的侧链结构有—CH=CHCH3,—C(CH3)=CH2,—CH2CH=CH2,其中—CH=CHCH3存在立体异构,共4种结构;其中核磁共振氢谱有五组峰,峰面积之比为1:2:2:2:3的物质结构简式为![]() ,故答案为:4;
,故答案为:4;![]() 。
。