题目内容
过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O ②Mn2+ + H2O2 = MnO2 + 2H+
下列说法正确的是( )
A.H2O2在①中是氧化剂,在②中是还原剂
B.在①中每生成1 mol O2,转移的电子数为1.204×1024
C.Mn2+在①中是还原产物,在②中是氧化产物
D.在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2
B
【解析】
试题分析:A.H2O2在①中是还原剂,在②中是氧化剂,所以A错误;C.Mn2+在①中是还原产物,在②中是氧化剂;所以C错误。D.在二氧化锰催化作用下,1 mol H2O2分解生成0.5 mol O2. D错误.
考点:过氧化氢性质的考查。

 阅读快车系列答案
阅读快车系列答案TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
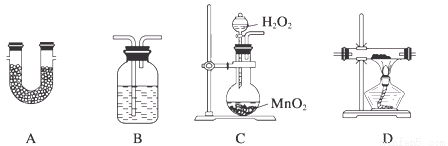
(1)将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加入的试剂的名称及作用。
选用的仪器 | 加入试剂 | 加入试剂的作用 |
C | H2O2溶液与MnO2 | 产生氧气 |
|
|
|
|
|
|
D | CuO粉末 | 将可能生成的CO转化为CO2 |
|
|
|
|
|
|
|
|
|
(2)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。