题目内容
2.下列物质在水中的电离方程式正确的是( )| A. | Na2CO3═Na2++CO32- | B. | NaHCO3═Na++HCO3- | ||
| C. | KClO3═K++Cl-+3O 2- | D. | H2SO4═H++SO42- |
分析 强电解质完全电离,用等号,弱电解质部分电离,用可逆号,原子团不能拆.据此解答.
解答 解:A.碳酸钠为强电解质,完全电离,电离方程式:Na2CO3═2Na++CO32-,故A错误;
B.NaHCO3为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故B正确;
C.KClO3为强电解质,完全电离,电离方程式:KClO3═K++ClO3-,故C错误;
D.H2SO4为强电解质,完全电离,电离方程式:H2SO4═2H++SO42-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意电离方程式遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
17.研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如表:
①该反应正向反应是吸热反应.(填“放热”或“吸热”)
②能判断该反应达到化学平衡状态的依据是BC.
A.容器压强不变 B.混合气体中c(CO2)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
③当其他条件不变时,若缩小容器的体积,该反应平衡不移动.(选填“正向”、“逆向”或“不”)
(2)工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{3}(H{\;}_{2})}$.
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同).测得CH3OH的物质的量随时间变化如图所示:
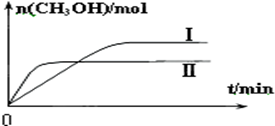
曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(选填“>”、“=”或“<”).
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
经测定甲容器经过5min达到平衡,平衡时CO2的转化率为50%,甲容器中该反应在5min内的平均速率υ(H2)=0.15mol•L-1•min-1.
要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.5<n(c)<1.
(1)在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②能判断该反应达到化学平衡状态的依据是BC.
A.容器压强不变 B.混合气体中c(CO2)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
③当其他条件不变时,若缩小容器的体积,该反应平衡不移动.(选填“正向”、“逆向”或“不”)
(2)工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{3}(H{\;}_{2})}$.
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同).测得CH3OH的物质的量随时间变化如图所示:

曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(选填“>”、“=”或“<”).
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.5<n(c)<1.
7.氧化-还原反应的本质是( )
| A. | 化合价的升降 | B. | 电子的转移 | C. | 原子的重新组合 | D. | 有新物质生成 |
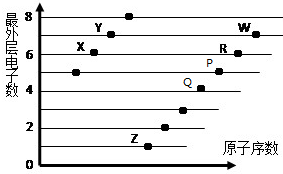 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题: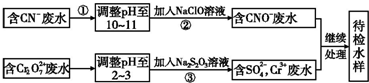 某工业废水中含有CN-和Cr2O${\;}_{7}^{2-}$等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
某工业废水中含有CN-和Cr2O${\;}_{7}^{2-}$等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: