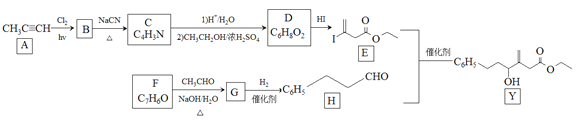
题目内容
【题目】室温时,若0.1mol/L的一元弱碱的电离度为1%,则下列说法正确的是( )
A.该溶液的pH=11
B.该溶液的pH=3
C.加入等体积0.1mol/LHCl后所得溶液的pH=7
D.加入等体积pH=3的盐酸后所得溶液的pH=7
【答案】A
【解析】
A、室温时,若0.1molL-1的一元弱碱的电离度为1%,则溶液中氢氧根离子浓度=0.1mol/L×1%=10-3mol/L,则氢离子浓度=![]() mol/L=10-11 mol/L,所以溶液的pH=11,故A正确;
mol/L=10-11 mol/L,所以溶液的pH=11,故A正确;
B、根据A的分析,溶液的pH=11,故B错误;
C、当加入等体积0.1molL-1HCl后二者恰好反应生成正盐,该盐是强酸弱碱盐,阳离子易水解,其溶液呈酸性,所以pH<7,故C错误;
D、当加入等体积pH=3的盐酸,反应后弱碱剩余,溶液显碱性,pH>7,故D错误;
故选A。

练习册系列答案
相关题目