题目内容
如图表示反应X(g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线
(1)200℃时,5min内用Y表示平均反应速率 .
(2)在8min时,Z的浓度为 .
(3)200℃时,第7min时刻,V(正) V(逆)(填“>”、“<”、“=”).
(4)从图中可以看出,a 200(填“>”、“<”、“=”).

(1)200℃时,5min内用Y表示平均反应速率
(2)在8min时,Z的浓度为
(3)200℃时,第7min时刻,V(正)
(4)从图中可以看出,a

考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法
专题:化学平衡专题
分析:(1)计算5min内X反应速率,利用计量数之比计算Y的反应速率;
(2)计算X的浓度变化,利用计量数之比计算Z的浓度;
(3)7min达到化学平衡状态,判断正逆反应速率大小;
(4)先达到化学平衡状态,温度越高.
(2)计算X的浓度变化,利用计量数之比计算Z的浓度;
(3)7min达到化学平衡状态,判断正逆反应速率大小;
(4)先达到化学平衡状态,温度越高.
解答:
解:(1)5min内X浓度变化为1.0mol/L-0.2mol/L=0.8mol/L,v(X)=
=0.016mol?L-1?min-1,v(Y)=4×0.016mol?L-1?min-1=0.64mol?L-1?min-1,
故答案为:0.64mol?L-1?min-1;
(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,故答案为:0.85mol/L;
(3)7min达到化学平衡状态,V(正)=V(逆),故答案为:V(正)=V(逆);
(4)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,故答案为:>.
| 0.8mol/L |
| 5min |
故答案为:0.64mol?L-1?min-1;
(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,故答案为:0.85mol/L;
(3)7min达到化学平衡状态,V(正)=V(逆),故答案为:V(正)=V(逆);
(4)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,故答案为:>.
点评:本题考查化学反应速率及化学平衡图象,注意把握曲线的变化趋势,正确判断外界条件对平衡移动的影响.

练习册系列答案
相关题目
下列有关叙述正确的是( )
| A、测定中和热时,大小两烧杯间填满碎纸的作用是固定小烧杯 |
| B、若用0.010mo1?L-1的氢氧化钠标准溶液滴定未知浓度的盐酸时,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,则测定结果偏小 |
| C、在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液 |
| D、进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |
阿魏酸在食品、医药等方面有着广泛用途.一种合成阿魏酸的反应可表示为
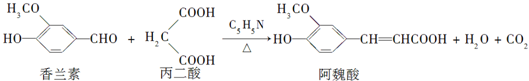
下列说法正确的是( )

下列说法正确的是( )
| A、可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 |
| B、与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有3种 |
| C、通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
| D、香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应 |
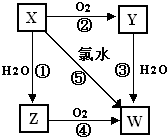 已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化