题目内容
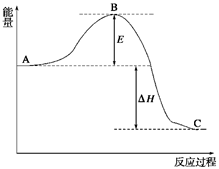
(12分) 2SO2(g)+O2(g)? ? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1) E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ;(2)图中ΔH= kJ/mol;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
;
(4)如果反应速率v(SO2)为0.05 mol/(L·min),则
 v(O2)= mol/(L·min)、v(SO3)= mol/(L·min);
v(O2)= mol/(L·min)、v(SO3)= mol/(L·min);
(5)已知S (s)+O2(g)? ?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH 。
?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH 。
 ? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1) E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ;(2)图中ΔH= kJ/mol;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
;
(4)如果反应速率v(SO2)为0.05 mol/(L·min),则
 v(O2)= mol/(L·min)、v(SO3)= mol/(L·min);
v(O2)= mol/(L·min)、v(SO3)= mol/(L·min);(5)已知S (s)+O2(g)?
 ?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH 。
?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH 。(1)没有影响 降低
(2)-198 (3)SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 (4)0.025 0.05
(5)-1 185 kJ/mol
(2)-198 (3)SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 (4)0.025 0.05
(5)-1 185 kJ/mol
(1)由图像可知E代表活化能,和反应热无关。催化剂能降低反应的活化能,从而加快反应速率。
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH=-198 kJ/mol.
(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 。
(4)因为化学反应速率之比是相应的化学计量数之比,所以v(O2)=0.025mol/(L·min)、v(SO3)=0.05mol/(L·min).
(5)考查盖斯定律的应用。由反应① 2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)
2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g) SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)
SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g) 2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=
2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH= 。
。
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH=-198 kJ/mol.
(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5 。
(4)因为化学反应速率之比是相应的化学计量数之比,所以v(O2)=0.025mol/(L·min)、v(SO3)=0.05mol/(L·min).
(5)考查盖斯定律的应用。由反应① 2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g)
2SO3(g) ΔH=-198 kJ/mol和②S (s)+O2(g) SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)
SO2(g) ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g) 2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=
2SO3(g) ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH= 。
。
练习册系列答案
相关题目

 的绝对值均正确)( )
的绝对值均正确)( )