题目内容
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如下图所示,列有关叙述正确的是( )
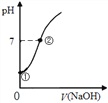
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
【答案】D
【解析】A.①点时没有加入氢氧化钠,溶液中存在HClO和水的电离平衡,故A错误;B.①到②溶液c(H+)之间减小,酸对水的电离的抑制程度减小,则水的电离程度逐渐增大,故B错误;C.②点时溶液存在Cl0-,具有强氧化性,可氧化I-,故C错误;D.②点时溶液pH=7,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故D正确;故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ | ⑾ |
(1)写出元素①单质的电子式
(2)这些元素形成的气态氢化物中,最稳定的是
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是
(4)③的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应的离子方程式为: 。