题目内容
常温时,将V1mL c1 mol/L的氨水滴加到V2mL c2 mol/L的盐酸中,下列正确的是
| A.若混合溶液的pH=7,则溶液中c (NH4+)> c (Cl—) |
| B.若V1=V2,c1=c2,则溶液中一定存在c(H+)=c (OH—),呈中性 |
| C.若混合溶液的pH=7,则一定存在c1V1>c2V2 关系 |
| D.若V1=V2,并且混合液的pH<7,则一定是由于盐酸过量而造成的 |
C
相关反应:NH3-H2O + HCl = NH4Cl + H2O
根据电荷守恒 c(NH4+) + c(H+)=" c" (Cl-) + c(OH-)
?如果两者完全反应,那么产物氯化铵为弱碱强酸盐,水解呈酸性,pH值应该小于7。
?如pH值为7,所以 c(H+)= c(OH-) ,可以得出 c(NH4+)=" c" (Cl-) ;如pH值为7,说明氨水加的量多了一点,抑制了铵根离子的水解,溶液才可能为7.所以得出C1V1>C2V2。
答案选C。
点评:考查酸碱混合,盐类水解相关知识。
根据电荷守恒 c(NH4+) + c(H+)=" c" (Cl-) + c(OH-)
?如果两者完全反应,那么产物氯化铵为弱碱强酸盐,水解呈酸性,pH值应该小于7。
?如pH值为7,所以 c(H+)= c(OH-) ,可以得出 c(NH4+)=" c" (Cl-) ;如pH值为7,说明氨水加的量多了一点,抑制了铵根离子的水解,溶液才可能为7.所以得出C1V1>C2V2。
答案选C。
点评:考查酸碱混合,盐类水解相关知识。

练习册系列答案
相关题目

 H3O+ + CO32-
H3O+ + CO32-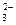 )>C(HCO
)>C(HCO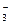 )>C(OH-)>C(H+)
)>C(OH-)>C(H+)